(一)什么是伴随诊断?
伴随诊断(Companion Diagnostics,简称CDx)之路始于1998年FDA批准的抗癌药物赫赛汀(Herceptin),它包括对某种药物进行的同步诊断和包括对某种生物制品进行同步诊断两种类型。
按照目前赫赛汀每次治疗均价2.5万左右计算,而每次接受肿瘤治疗药物测试价格300元/次(福建省卫计委公布最新价格)。因此,比起盲目服用高昂的药物以及忍受冗长的治疗周期,伴随诊断技术有助于快速判断抗癌药物方案是否适合具体的患者。
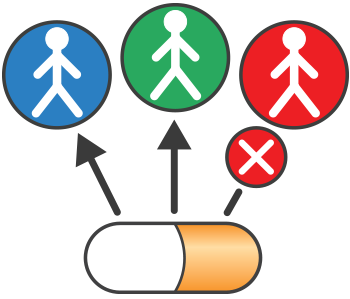
根据美国FDA官方网站的定义:伴随诊断疗法是一种医疗器械,作为一种体外诊断(IVD)技术,能够提供有关患者针对特定治疗药物/生物制品的治疗反应的信息。这种测试有助于判断某种治疗产品的受益患者群体、严重副作用群体和潜在风险群体。
具体而言,伴随诊断可以做以下三件事情:
1)确定哪些患者是某种特定疗法的最可能受益群体;
2)确定患者在接受某种特定疗法后可能产生的严重的副作用;
3)监控与特定治疗对治疗的反应产品调整治疗的目的来实现改进的安全性或有效性。
值得一提的是,如果诊断测试是不准确的,那么基于测试结果的治疗决策可能不是最优的。
(二)美国FDA发布最新的药物/诊断共同开发指导原则(草案)
早在2014年7月31日,FDA发布了《体外伴随诊断测试产业指南》,旨在帮助制药企业在早期的药物研发中确定是否需要伴随诊断以及是否需要制定药物和伴随诊断的联合开发计划。

2016年7月15日,FDA公布了指南草案——《体外伴随诊断设备与治疗产品的共同开发指导原则》,该文件旨在成为一份实用指南,以帮助药企和诊断试剂商更好地进行“药物-诊断”合作开发。
FDA表示,这份指南草案将在其官网上公示90天至10月13日,公民可以通过www.regulations.gov.网站进行反馈留言;也可以通过写信给FDA的文档管理部进行反馈留言。
这份文档究竟说了些啥呢?生物探索编辑通过通读文档,带你提前了解。
(三)《指导原则》的大纲内容
I. 序言 .............................................................................................................4
II. 背景 ............................................................................................................6
III. 共同开发过程的原则 ................................................................................7
A. 一般原则 ....................................................................................................8
B. 体外诊断和治疗产品的监管条例 .............................................................9
1. 风险评估和医疗器械临床试验申报要求 ....................................................10
2. 在研药物或生物制品相关的IVD信息递交 ..................................................13
3. 共同开发试验中IVD产品的医疗器械临床试验申报要求 ..........................14
C. 潜在合作发展项目的IVD验证计划 .........................................................15
1. 研究性IVD试剂在治疗产品试验前的分析验证预期 ...................................15
2. IVD试剂的新型用途 ........................................................................................16
3. 治疗产品早期临床试验阶段的IVD试验 ........................................................16
4. 研究试剂仅作测试系统的一部分 ...................................................................17
5. 筛选可用于治疗产品临床试验的IVD .............................................................18
6. 分析前程序和测试协议 ....................................................................................19
7. 分析验证研究的前瞻性规划 ............................................................................19
D. 治疗产品临床试验设计注意事项 ...............................................................20
1. 早期治疗产品开发的一般注意事项 .................................................................21
2. 晚期治疗产品开发的一般注意事项 .................................................................22
3. 预后及预测标记物 .............................................................................................24
4. 前瞻性回顾的方法 .............................................................................................25
5. 确定预期人群的注意事项 .................................................................................26
E. 晚期治疗产品的IVD开发注意事项 ...........................................................28
1. 训练样本集与验证样本集 .................................................................................29
2. 实验设计的变量影响 .........................................................................................29
3. IVD 衔接性试验 .................................................................................................30
4. 特殊方案的评估 .................................................................................................31
F. 同期营销授权计划 ......................................................................................32
1. 协调审核时间表 .................................................................................................32
2. 什么条件下不能进行同期营销授权 .................................................................37
3. 一种IVD伴随诊断在获得营销授权前的装运与验证 ......................................37
G. 标签注意事项 ..............................................................................................38
1. 试验性IVD伴随诊断的要求 ..............................................................................38
H. 上市前注意事项 ...........................................................................................40
附录1:共同开发过程的关键点 ......................................................................41
附录2:主要样本处理的注意事项 ...................................................................43
附录3:递交PMA前的BIMO信息 ....................................................................46
附录4:授权书 ..................................................................................................47

2023年8月28日,北京——安捷伦科技公司(纽约证交所:A)近日宣布其PD-L1检测试剂盒(免疫组织化学法)(货号SK006)获得伴随诊断(CDx)C类IVDR认证。该CDx检测之前已拥有CE-IV......
2022年5月16日,北京——安捷伦科技公司(纽约证交所:A)近日宣布其PD-L1检测试剂盒(免疫组织化学法)(货号SK006)现已获得欧盟CE-IVD认证,可用于宫颈癌。PD-L1检测试剂盒(免疫组......
近日,美国食品和药物管理局(FDA)计划推出针对个体化抗癌药物伴随诊断的分类标签。本月早些时候,FDA发布了相应的指南草案,概述了该分类标签适用于个体化癌症治疗伴随诊断的情况。该草案描述了当前伴随诊断......
盖伦奖(PrixGalienAward)被公认为制药和生物医疗行业的最高荣誉,旨在褒奖医疗、科学在研究与创新领域所取得的卓越贡献,被誉为“医药界的诺贝尔奖”。为了帮助大家更加深入地了解这些优秀的医疗器......
伴随诊断是一种体外诊断技术,能够提供有关患者针对特定治疗药物的治疗反应的信息,有助于确定能够从某一治疗产品中获益的患者群体,从而改善治疗预后并降低保健开支。伴随诊断行业概况随着个性化医疗和精确治疗时代......
2017年盛夏,基因编辑技术应用的全球领导者HorizonDiscovery公司(伦敦证券交易所:HZD),宣布其与国际知名NGS公司合作的肿瘤伴随诊断试剂盒携Horizon分子诊断标准品成功通过FD......
2016年,默沙东和百时美施贵宝的癌症免疫治疗药物Keytruda及Opdivo全球销售额分别为14亿美元及38亿美元,而随着适应症的进一步扩大以及免疫疗法更多深入人心的试验数据的公布,必将会吸引更多......
近年来,伴随诊断作为治疗的一个组成部分已经引起癌症研究者和制药、生物公司的广泛关注。伴随诊断的重要性在癌症领域尤其凸显,好的生物标志物可以帮助制药公司快速锁定目标以及高效地设计临床实验。摒弃“非选择性......
2016年12月19日,美国食品和药物管理局(FDA)批准了FoundationMedicine公司的FoundationFocusCDxBRCA产品,成为市场上第一个基于二代测序的伴随诊断试剂盒。该......
“癌症治疗的趋势是有针对性的个体化医疗。”在日前于厦门举行的伴随诊断会议上,专家指出,“伴随诊断”和“靶向治疗”是肿瘤个体化精准治疗最重要的两大工具,且伴随诊断相较于化疗更有助于提高某些患者群体的生存......