继上次发表的Guide RNA设计和筛选的相关知识之后,希望大家还没有忘记相关的操作和技巧,今天,我们就来和大家聊聊后续的实验,在基因编辑鼠的过程中,sgRNA表达载体是如何构建的呢?
在靶点筛选结束之后,下一步就要进行sgRNA载体构建。在构建表达载体前,应根据实验目的选取合适的表达质粒。比如进行实验时考虑是否需要reporter标签,是否需要药物筛选基因等。
接下来以构建px330质粒为例,具体说明如何构建sgRNA表达载体。(图1)
先确定20bp靶标序列(基因组序列应为20bp+NGG);
如20bp第一个为G,则略过此部分;在20bp前额外添加一个G,形成G+20bp序列(U6 human promoter转录时需要起始碱基为G);
在20bp或G+20bp 5’前添加caccg,形成cacc-G+20bp序列,则为Forward序列(直接合成即可);
将20bp或G+20bp 进行反向互补,并在5’前添加aaac,则为Reverse序列(直接合成即可);
合成的sgRNA正反向碱基(摩尔浓度为100μM)进行退火,使之碱基配对并形成双链结构;
BbsI酶切px330质粒,并对酶切后的载体进行回收;
将退火配对后的sgRNA碱基用超纯水按1:200稀释,并与回收后的载体进行连接;
连接产物进行转化,氨苄抗性固体培养板进行涂板;
挑取单克隆菌落,扩大培养后提取质粒,并使用human U6通用引物对连接载体进行测序,检测sgRNA 碱基片段是否正确插入px330质粒。
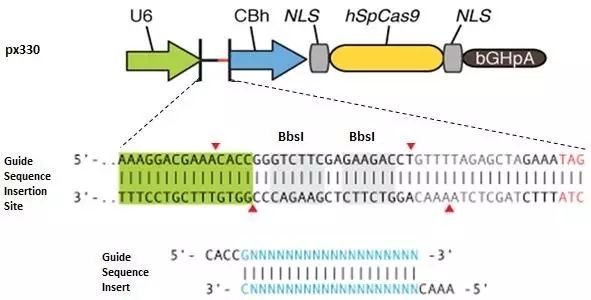
图1.px330 sgRNA表达载体构建示意图
然而,在进行受精卵显微注射时为了增加基因编辑的效率,一般以RNA形式替代DNA质粒形式。以下为构建sgRNA体外转录载体pGS3-T7-sgRNA步骤。(图2)
确定20bp sgRNA靶序列,按上述操作将其连接至BbsI酶切的pGS3-T7-sgRNA中,测序并挑选正确插入的质粒;
pGS3-T7-sgRNA质粒线性化:用DraI酶切1μg pGS3-T7-sgRNA质粒,37℃反应3h;
以构建正确的pGS3-T7-sgRNA为模板,配制体外转录反应溶液(体系见表1);
将上述溶液均匀混合后轻微离心,将转录反应液收集于反应管底部,42℃反应 2 小时;
加3μl RNase-Free DNase I至20μl反应体系中,充分混合后置于37℃反应30min;
加77μl RNase-free 纯水以终止反应继续进行;
使用酚氯仿和异丙醇方法纯化转录后的RNA;
取反应液的一部分进行4% 琼脂糖凝胶电泳,确认体外转录后的 RNA 产物;
测定RNA浓度,用以显微注射。

图2. pGS3-T7-sgRNA载体构建及体外转录示意图
|
试剂 |
用量 |
|
Transcription buffer ,10 x |
2μl |
|
Template DNA ,200ng/μl |
5μl |
|
ATP ,50mM |
2μl |
|
GTP ,50mM |
2μl |
|
CTP ,50mM |
2μl |
|
UTP ,50mM |
2μl |
|
Rnase inhibitor ,40U |
0.5μl |
|
RNA polymerase , 50U |
2μl |
|
RNase-free H2O |
2.5μl |
表1. sgRNA T7-体外转录反应体系
Cas9表达载体体外转录步骤。(图3)
pSP6-Cas9质粒线性化:用NotI单酶切5μg pSP6-Cas9质粒,37℃反应5h;
0.8%或1%琼脂糖凝胶电泳,并进行DNA凝胶纯化回收,测定浓度;
以纯化DNA为模板,按mMessage mMachine SP6体外转录试剂盒说明书配制反应溶液(体系见表2);
将上述溶液均匀混合后轻微离心,将转录反应液收集于反应管底部,37℃反应 2 h;
加1μl TURBO DNase至反应溶液中,混匀并在37℃反应15min;
加30μl nuclease-free 纯水及30μl 氯化锂溶液,混匀溶液并在-20℃冷冻30min;
4℃、14,000g离心10min以沉淀mRNA,小心去除上清溶液。并用500μl 70%乙醇清洗一遍,同时再次4℃、14,000g离心10min;
吸净上清乙醇溶液,室温干燥5min,最后用20μl RNase-free 纯水溶解mRNA沉淀,混匀后置冰上并测定浓度,最后置于-80℃或-150℃保存。

图3. pSP6-Cas9载体构建及体外转录示意图
|
试剂 |
用量 |
|
Transcription buffer ,10 x |
2μl |
|
Template DNA ,200ng/μl |
5μl |
|
SP6 NTP/CAP ,2 x |
2μl |
|
SP6 enzyme mix |
2μl |
|
RNase-free H2O |
9μl |
表2. Cas9 mRNA SP6-体外转录反应体系
参考文献:
Shao Y et al., CRISPR/Cas-mediated genomeediting in the rat via direct injection of one-cell embryos. Nat Protoc. 2014Oct;9(10):2493-512.
中国农业科学院郑州果树研究所西瓜遗传育种与栽培创新团队使用了一种被称为“发根农杆菌”的微生物,帮助西瓜快速生出许多小小的毛状根,通过这些毛状根快速稳定地提升西瓜的基因编辑效率。相关研究成果日前发表在国......
近日,复旦大学附属眼耳鼻喉科医院主任医师黄锦海、周行涛团队,与暨南大学附属深圳眼科医院教授雷和田团队、温州医科大学附属眼视光医院教授王勤美团队合作,开发了一种针对VEGFA基因的CRISPR/Cas9......
据国外媒体报道,美国麻省总院于3月16日实施一例临床异种肾移植,这位男性患者术后恢复良好,已于美国当地时间4月3日下午出院回家。“这是全球第一例接受基因编辑猪的器官移植走出医院的病人。”华中科技大学同......
目前大多数获批的基因疗法,包括涉及CRISPR-Cas9的基因疗法,都是对体内取出的细胞在体外进行基因编辑,然后将这些经过编辑的细胞输注回到患者体内。这种技术非常适合靶向血细胞,目前新批准的治疗镰状细......
“今年两会,我的一个提案是建议尽早正式发布基因编辑动物安全评价指南,并制定和发布农业用基因编辑动物的评审细则,让基因编辑动物的研发单位对产业化路径能有清晰的预期。”两会期间,全国政协委员、中国科学院院......
据英国《新科学家》网站2月24日报道,国际育种公司Genus借助CRISPR技术,对猪进行了基因编辑,使其能避免患上猪繁殖与呼吸障碍综合征(PRRS)。相关论文发表于最新一期《CRISPR》杂志。该公......
基于CRISPR的基因组编辑已成功应用于镰状细胞病,其他公司正在致力于开发基于CRISPR的疗法。这项技术应用到动物身上似乎是很自然的事情。现在,英国动物遗传学公司Genus的科学家团队在威斯康星州和......
一些遗传性基因缺陷会导致过度的免疫反应,这可能给患者带来致命伤害。在一项最新研究中,德国科研团队借助CRISPR-Cas9基因编辑工具,纠正了这些缺陷,使免疫反应正常化。相关研究论文发表于2日出版的《......
英国剑桥大学科学家进行了一项基于CRISPR新型基因疗法的首次治疗试验,10名罹患罕见炎症疾病遗传性血管性水肿的患者接受了治疗。结果显示,其中9人几乎痊愈,这表明新基因疗法或能治愈危险的炎症疾病。相关......
2022年1月10日,马里兰大学医学院宣布完成了世界首例基因编辑的猪心脏人体器官移植,这项研究成为异种器官移植的里程碑,为广大苦苦等待供体器官的患者带来了新曙光。2024年1月18日,eGenesis......