自2009年Hans Clevers团队首次利用小鼠LGR5+小肠干细胞在体外培养出小肠类器官以来,肠道类器官模型被广泛应用于肠道相关疾病研究领域。与传统实验模型(细胞系2D培养及动物模型)相比,肠道类器官具有多种优势。体外构建的肠道类器官模型包含所有类型的肠上皮细胞,并具有水、离子吸收和转运等生理功能,这些优势是单一细胞系所无法比拟的。此外,动物模型与人类存在较大的种属差异,无法完全模拟人体肠道的真实生理反应,而来源于人体组织的肠道类器官能够更加准确的反应人体的生理及病理变化。 本文筛选了几篇利用肠道类器官技术来研究肠道疾病的文章,供您参考,以便为您的研究带来一些启示。
1.肠衰竭治疗
英国弗朗西斯·克里克研究所Vivian S. W. Li和伦敦大学Paolo De Coppi团队合作发现,利用儿科肠道衰竭患者类器官可设计构建自体空腔粘膜移植物,这一突破性研究成果于2020年9月7日(标明年份),在Nature Medcine杂志上发表,题为《Engineering transplantable jejunal mucosal grafts using patient-derived organoids from children with intestinal failure》。研究者将完整的纳米形貌的脱细胞人肠基质作为生物支架。蛋白质组学和拉曼光谱分析揭示了人类小肠和结肠支架的高度相似的生化特征,表明它们可以互换用作肠工程的平台。而后,研究者将体外扩增的空肠类器官植到任一类型的支架上都可以有效地重建具有消化和吸收等生理功能的空腔移植物,该移植物移植到小鼠肾囊或皮下可存活并形成管腔结构。该研究为肠衰竭儿童使用工程化改造的患者特异性空肠移植提供了概念验证数据,推动了患儿肠衰竭治疗的临床试验进程。

来自两个病人的(SI和Colon)脱细胞结肠支架生物分子特征(黄色箭头指示肠隐窝结构;红色箭绒毛结构)

组织切片显示移植物中存在肠上皮形成的肠腔结构
2.肠再生及微生物感染研究
2020年9月瑞士洛桑理工学院的Matthias P. Lutolf团队在Nature杂志上发表题为《Homeostatic mini-intestines through scaffold-guided organoid morphogenesis》的文章,开创性地提出 了“芯片上的类器官”这一概念,研究人员将小肠干细胞与肠形水凝胶支架结合,诱导这些细胞形成具有小肠绒毛结构和隐窝结构的功能性肠上皮细胞类器官(迷你小肠)。迷你小肠与外部抽水系统连接时,可进行灌洗,以去除内部死细胞。与传统类器官相比,迷你小肠能够实现更多与生理相似的结构、体积和功能。研究人员利用该模型明确了迷你肠的再生能力及作为寄生虫感染模型的潜力。

培养第10天,灌注9h以去除官腔内部积累的死细胞
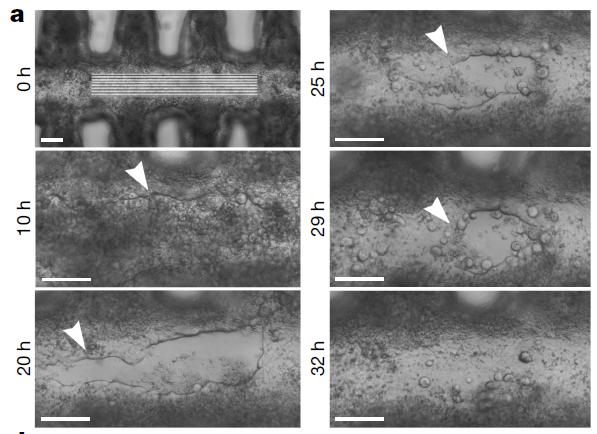
靶向激光小肠损伤的伤口愈合
3.SARS-CoV-2病毒研究
2020年7月3日类器官研究的开创者Hans Clevers及其团队在Science杂志上发表了一篇题为《SARS-CoV-2 productively infects human gut enterocytes》的文章,该研究发现在小肠类器官中新冠病毒很容易感染肠上皮细胞,且感染后的肠上皮细胞的病毒应答基因显著上调。该研究为肠上皮细胞支持SARS-CoV-2的复制提供了证据,提示人肠道类器官可作为病毒感染和生物学研究的实验模型。
四种不同培养状态下小肠类器官,感染SARS-CoV和SARS-CoV-2后均可以检测到较高滴度的病毒水平,表明这两种病毒均可以感染小肠类器官。随后研究者通过共聚焦和电子显微镜确定了SARS-CoV-2可感染的细胞类型是肠上皮细胞谱系以及病毒感染的过程和生活周期。最后研究者通过mRNA序列分析确定了SARS-CoV-2感染引起的基因表达变化,即I型和III型干扰素通路的细胞因子和干扰素刺激基因(ISG)被强烈诱导上调。

病毒入侵肠上皮细胞(白色为病毒RNA)

SARS-CoV-2感染引起基因表达变化
4.微生物代谢物筛选
2020 年 7 月 29 日,以色列希伯来大学的 Yinon
Ben-Neriah 团队在 Nature 上发表了题为《The gut microbiome switches mutant p53 from
tumour-suppressive to oncogenic》 的研究论文,该研究发现肠道菌群可将突变型p53基因从促癌基因转变为抑癌基因。
为了研究突变的p53在小鼠肠道肿瘤模型中的作用,研究者将突变的p53引入了由Csnk1a1缺失或ApcMin突变引起的WNT驱动的肠癌小鼠模型中,发现突变的p53在两种WNT驱动的小鼠癌症模型中均表现出两种相反的效应:抑制近端肠道(微生物较少)的肿瘤发生,但增强远端肠道(微生物密集)的肿瘤发生。研究者通过使用抗生素消除了小鼠的肠道菌群,在p53突变体的小鼠肿瘤模型中发现,抗生素处理消除了在结肠和回肠中的不典型增生,且WNT
的激活也减少,从而提示肠道菌群对抗 p53 突变体介导的 WNT 抑制作用,从而促进远端肠癌的发生。
研究人员推测存在于远端肠道中的特定细菌代谢物可能具有消除p53突变体的WNT抑制作用的潜力,为了验证这一推测研究者通过用与肿瘤发生相关的代谢物处理p53突变体的肠癌类器官来进行筛选,最终发现只有没食子酸(源自肠道菌群的单一代谢物)可显著增加类器官的增殖能力和WNT活性。在该研究中,研究者使用肠癌类器官模型作为筛选改变p53突变功能的菌群代谢物,为该机制的研究提供证据。

肠道肿瘤类器官在没食子酸连续处理9天或先在没食子酸处理5天后移除没食子酸的免疫荧光图
5.体外Wnt信号调控机制研究
2020年1月 Madelon M Maurice团队在Trends Cell Biol杂志上发表了一篇题为《Wnt Signaling in 3D: Recent Advances in the Applications of Intestinal Organoids》的综述,该文章总结了Wnt信号通路在肠道类器官中的最近研究进展。研究人员回顾了如何使用成体干细胞和患者衍生的类器官来研究Wnt/b-catenin信号通路及其在组织稳态和癌症中的调控。
在静息态细胞中转录辅激活因子b-catenin,被“破坏复合体”(APC、AXIN, GSK3, CK1) 隔离,通过wnt介导的FZD及其协同受体LRP5/6的激活,破坏复合物的关键组分被招募至质膜使得b-catenin在细胞质中积累并转运到核中。随后,核b-catenin与TCF/LEF家族的转录因子关联,驱动Wnt靶基因的表达,此为正反馈调控。Wnt信号可被膜结合的能够促进FZD受体泛素依赖性内吞和溶酶体降解的E3连接酶RNF43和ZNRF3所平衡,此为负反馈调控。RNF43和ZNRF3的活性又会被Rspo平衡,Rspo是一种由干细胞龛分泌的wnt增强因子。正负反馈调控及Rspo共同维持组织稳定的状态。突变诱导的Wnt / b-catenin信号激活和Wnt靶基因表达的失调与癌症的发生息息相关。“破坏复合体”核心成分APC,axin和b-catenin突变引起的下游Wnt信号途径的激活,及RNF43 /LGR5 / Rspo轴被认为是主要的癌症驱动因素。除Wnt信号通路调控外,研究者还讨论了小鼠和人的肠道类器官Wnt相关基因型和表型关系的异同,以及在应用这些类器官进行疾病建模时存在的缺陷及未来潜在研究方向。

Wnt/b-Catenin信号通路图
6.模拟饮食-微生物-宿主互做
2020年3月,意大利特伦托大学细胞生物学中心的 Andrea Lunardi团队在Trends Endocrinol Metab杂志上发表了题为《Intestinal Organoids: A Tool for Modelling Diet–Microbiome–Host Interactions》的综述,主要内容包含四大部分1) 饮食、微生物菌群和肠道微生物代谢物介绍;2) 肠道类器官培养揭示了植物化学物质在组织稳态和疾病中的作用;3) 探讨了肠道上皮微生物对肠道结构和功能的影响;4) 评估了肠道类器官对微生物和微生物代谢物相互作用的响应策略:从整体组织到单细胞。肠道类器官具有足够的复杂性来模拟生理以及病理的饮食-微生物-宿主条件,有助于阐明其相互作用的机制,并将为理解和治疗胃肠道疾病打开新的可能性。

肠道微生物代谢物(GMMs)与肠道微生物和饮食联系图
起源于肠道干细胞的肠道类器官,因其相对容易获得,培养周期短,可传代、冻存并保持稳定遗传,并且可以模拟人体肠道的真实生理反应,已广泛应用于肠衰竭研究、创伤修复、病毒研究、肠道干细胞调控机制研究和肠道微生物研究等多个领域。然而将肠道类器官应用于临床医学治疗,仍然有很多问题亟需解决,例如如何在肠道类器官中引入血管,如何与免疫系统和神经系统建立连接等等。随着类器官技术的不断发展,科学家已逐渐将类器官技术与组织工程学、材料学、生物物理学等多种领域结合起来,这加速了肠道类器官研究向临床应用转化的进程,或许不久的将来我们就可以看到应用肠道类器官技术治疗多种肠道疾病。