辉瑞(Pfizer)近日宣布,美国食品和药物管理局(FDA)已受理该公司提交的一份补充新药申请(sNDA)并授予了优先审查。该sNDA申请批准Braftovi(encorafenib)与Erbitux(cetuximab,西妥昔单抗)联合用药方案(Braftovi二药方案),用于先前治疗后病情进展的BRAF V600E突变阳性、转移性结直肠癌患者(mCRC)的治疗。FDA已指定该sNDA的处方药用户收费法(PDUFA)目标日期为2020年4月。
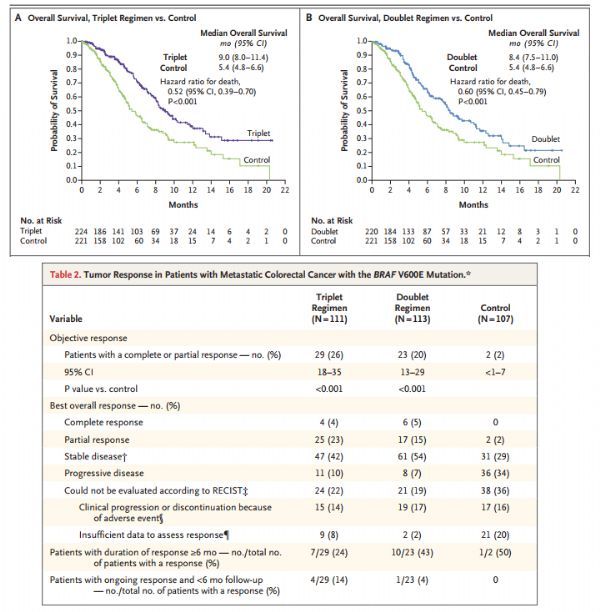
该sNDA基于III期BEACON CRC试验的结果。该研究在先前接受过一种或两种疗法治疗后病情进展的晚期BRAF V600E突变mCRC患者中开展,评估了Braftovi二药方案和Braftovi三药方案(Braftovi+Erbitux+Mektovi)相对于Erbitux与含伊立替康的治疗方案联合用药(对照)的疗效和安全性。
结果显示,与对照组相比,Braftovi二药方案治疗组和三药方案治疗组总生存期(OS)和客观缓解率(ORR)均表现出改善。描述性分析结果显示,在总的研究群体中,二药方案和三药方案的疗效相当。二药方案和三药方案没有表现出非预期的毒性。
辉瑞全球产品开发肿瘤学首席开发官、医学博士Chris Boshoff表示:“FDA受理了我们的Braftovi二药方案申请,这对于携带BRAF V600E突变的mCRC患者来说是一个非常令人鼓舞的消息。目前,还没有FDA批准的治疗方法专门用于先前接受过治疗的BRAF突变mCRC患者。这些患者通常预后不佳,如果获得批准,Braftovi二药方案将成为该患者群体的第一个靶向治疗方案。我们也期待着继续探索这种靶向二药方案联用或不联用Mektovi,用于BRAF突变mCRC的早期治疗,包括在正在进行的II期ANCHOR研究中治疗先前未接受治疗的BRAF突变mCRC患者。”
今年11月2日,欧洲药品管理局(EMA)也启动了审查程序,对法国制药公司皮尔法伯集团(Pierre Fabre)提交的Braftovi二药方案治疗BRAF V600E突变mCRC患者的II类变更申请进行审查。
Braftovi的活性药物成分binimetinib是一种口服小分子BRAF抑制剂,Mektovi的活性药物成分encorafenib则是一种口服小分子MEK抑制剂。MEK和BRAF是MAPK信号通路(RAS-RAF-MEK-ERK)中的2种关键蛋白激酶。研究表明,这一通路调节了包括细胞增殖、分化、存活、血管生成在内的多种关键细胞活动。在许多癌症中,如黑色素瘤、结直肠癌和甲状腺癌,这一信号通路中的蛋白质已被证实异常激活。
在美国,Braftovi+Mektovi组合已被批准用于BRAF V600E或BRAF V600K突变的不可切除性或转移性黑色素瘤。Braftovi不适合治疗野生型BRAF黑色素瘤。在欧洲,该组合被批准用于BRAF V600突变的不可切除性或转移性黑色素瘤成人患者。在日本,该组合被批准用于BRAF突变的不可切除性黑色素瘤。
Braftovi和Mektovi由Array BioPharma发现和开发。今年6月,辉瑞以114亿美元将Array BioPharma收购。目前,辉瑞拥有2款药物在美国和加拿大的独家权利。小野制药授权获得2款药物在日本的韩国的独家权利,Medison授权获得2款药物在以色列的独家权利,皮尔法伯集团授权获得2款药物在所有其他国家的独家权利,包括欧洲、拉美和亚洲(日本和韩国除外)。
北京时间今天凌晨,巴西布坦坦研究所宣布中国科兴公司研制的疫苗有效率确定超过50%,达到了巴西规定的疫苗使用标准。同时该研究所表示,应科兴公司的要求,具体有效率等数据要在接下来最多15天的时间内推迟公布......
获批之后,辉瑞疫苗已在美国展开接种,首批分发对象为一线医护、老年人等高风险人群。但很快,美国首例对辉瑞疫苗过敏的案例出现,加剧了人们对疫苗的担忧。12月16日周三,美国阿拉斯加州报告称,该州一名医护人......
11月9日,美国辉瑞公司宣布,其与德国生物技术公司BioNTech合作研发的mRNA新冠候选疫苗BNT162b2三期临床试验有效性超过90%[1]。这一数据远高于此前许多业内专家对新冠疫苗有效性的预测......
突发重磅!辉瑞释放疫苗大消息,能阻止90%感染!欧美市场狂欢,道琼斯指数大涨超4%,原油疯涨,欧股涨幅则继续扩大,西班牙IBEX35指数涨超7.5%,意大利富时MIB指数涨超6%,德国DAX指数涨超5......
随着新冠疫苗的大规模临床试验加速推进,疫苗产生的副作用也随之暴露。上周阿斯利康因接种者出现不明原因的副作用,一度紧急叫停了新冠疫苗的全球临床试验。辉瑞公司周二也透露,其在正在进行的新冠疫苗后期研究发现......
辉瑞(Pfizer)近日宣布,美国食品和药物管理局(FDA)已批准一份补充新药申请(sNDA):将Braftovi(encorafenib)与Erbitux(cetuximab,西妥昔单抗)联合用药方......
近日,辉瑞公布了20价肺炎球菌结合疫苗(20vPnC)PF-06482077一项III期临床研究(NCT03760146)的顶线结果。这是一项随机双盲研究,共入组了3880例年龄在18岁及以上无肺炎球......
19日,IDEAYABiosciences宣布,已与辉瑞(Pfizer)签订一项临床研发合作协议,以评估IDEAYA公司的在研蛋白激酶C(PKC)小分子抑制剂IDE196和辉瑞的MEK抑制剂binim......
随着2019新型冠状病毒疾病(COVID-19)在世界范围的传播越来越广泛。全球生物医药产业中的更多公司投入到抗击COVID-19的研究中来,它们开展多项合作,同舟共济,迅速开发针对COVID-19的......
辉瑞(Pfizer)与礼来(EliLilly)近日宣布,美国食品和药物管理局(FDA)已受理单抗药物tanezumab(2.5mg,皮下注射[SC])的生物制品许可申请(BLA),该药目前正被评估用于......