蛋白质作为疾病生物标志物和药物靶点在现代生物医学中具有举足轻重的作用,蛋白质组学是分析生物体内所有蛋白质的组成与定量的有效手段。传统的蛋白质组检测的是整块组织或分离后的细胞中的蛋白表达水平,失去了空间位置信息。然而,由于组织异质性,组织中不同细胞表达的蛋白种类和数量可能存在显著性差异,获得组织空间定位的蛋白表达图谱有助于解析组织微环境、肿瘤异质性,并在疾病的精细化诊断、药物选择及预后评估等方面发挥着重要作用。当前针对蛋白质组开发的空间检测技术百花齐放,如基于激光捕获显微切割(LCM)技术,基质辅助激光解吸电离(MALDI)和液体萃取表面分析(LESA)等。以上技术都在力求使用高精尖的设备实现更高的分辨率下微量样本的空间蛋白质组学分析。那除此之外,是否还有别的思路呢?
西湖实验室 Kiryl D. Piatkevich 团队联合郭天南团队另辟蹊径,采取截然不同的方法,首先使用 “吸水后能膨胀到原来的N倍” 的水凝胶放大实际样品,再结合4D蛋白质组学技术助力微量样本的蛋白质组学分析,开发了一种简单、便捷、稳定、可重复的空间蛋白质组学分析方法,并称之为ProteomEx(该名称由Proteomics + Expansion合并组成)。这项工作于2022年11月30日发表在Nature Communications,题目为“Spatially resolved proteomics via tissue expansion”。

文章链接:https://www.nature.com/articles/s41467-022-34824-2
ProteomEx由6个主要步骤组成(图1),包括组织膨胀、染色、成像、取材、取材组织多肽回收,以及对回收的多肽进行质谱分析。虽然从固定组织到质谱分析的整个过程需要58个小时,而真正需要实验人员动手操作的时间则不超过5小时,膨胀线性倍数最大可到8倍,相当于体积扩大512倍。且ProteomEx方法无需借助特殊设备,只需通过人工采样,即可获取感兴趣的单个区域。
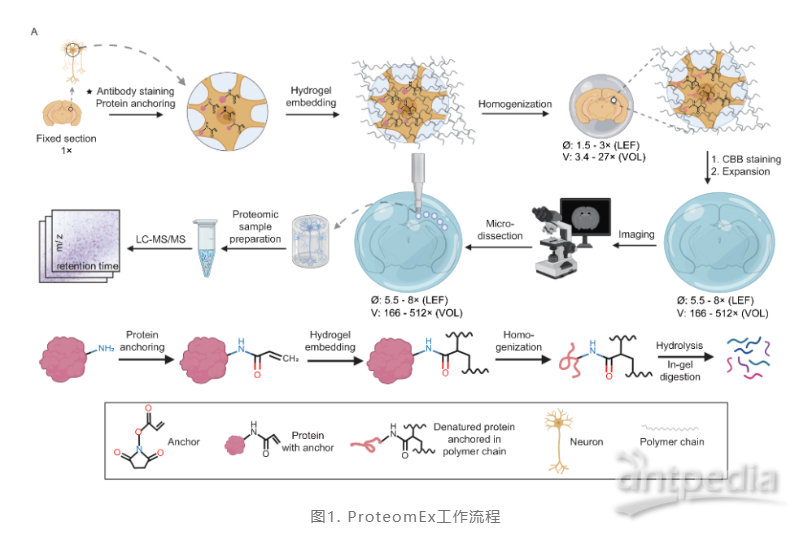
生物组织的物理放大可以分为四步完成。第一,先用化学锚定分子修饰在样品的蛋白质上,而锚定分子伸出的手臂可以连接在聚合物网状结构的分子上。下一步,再用可以形成聚合物的砌块或者单体扩散到样品里。接着,通过聚合反应,单体可以在生物分子之间自组装成长链。非常重要的是,在聚合过程中生物分子可以牢固地结合在聚合物的网筛上。而这个结合,可以允许把生物分子拉开。之后,通过使用一种特殊筛选的化合物处理之前形成的聚合物复合物,从而去除生物分子之间的联系,避免影响后续的膨胀过程。与此同时,当加入水后,聚合物材料可吸水膨胀,聚合物链延展开来,如动画里展示的内容,生物分子也会随之分开。
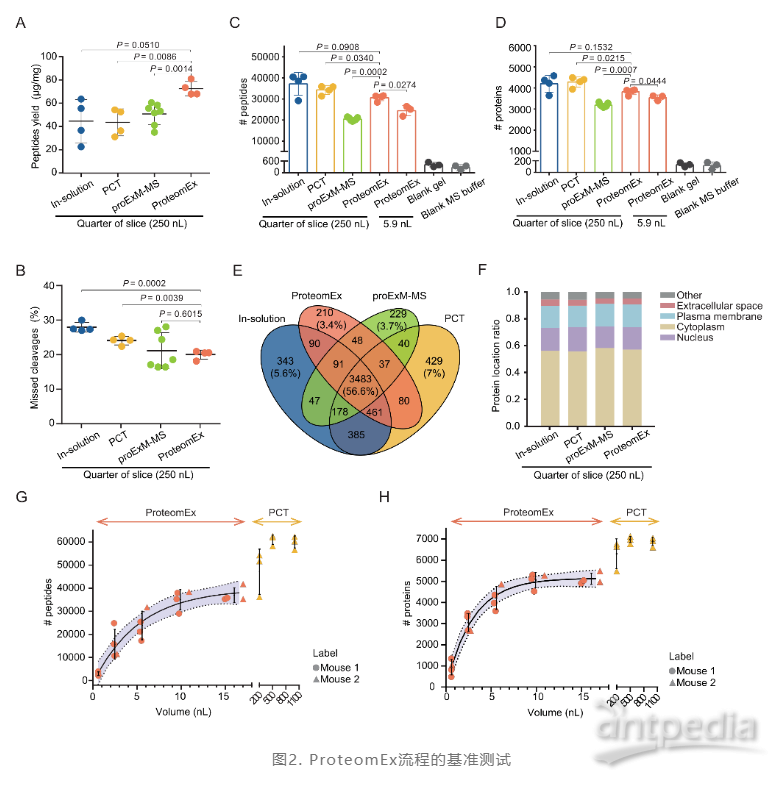
对于ProteomEx这项全新开发的技术,研究者们首先对它与其他几种已有的蛋白质组学方法(溶液内酶解方法In-solution、压力循环技术酶解方法PCT)进行了多个维度的比较。此外,在本研究的进行过程中,Drelich等人发表了一种概念上相似的方法proExM-MS,研究人员也将它纳入了比较。结果显示,与In-solution、PCT、proExM-MS相比,ProteomEx在蛋白质鉴定的定性、定量、翻译后修饰等方面与其他方法结果相接近,同时可实现更高的多肽提取效率和更低的肽段漏切率,从而稳定获取空间横向分辨率~160 μm的微量样本,相当于0.61 nL的组织体积。
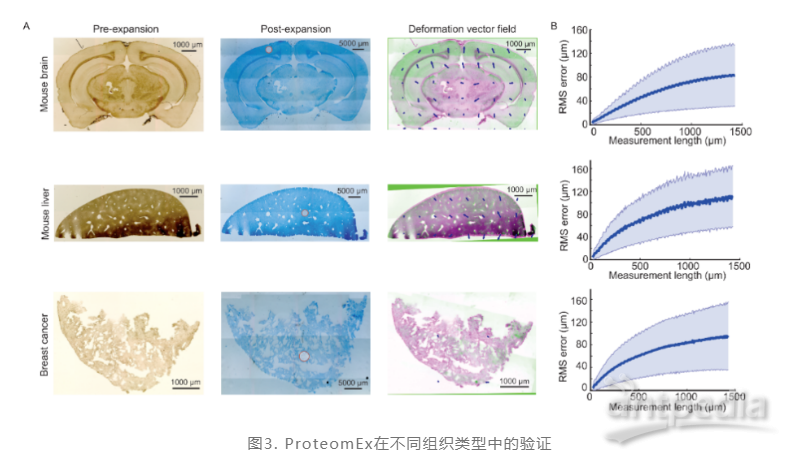
与此同时,为了评估ProteomEx对哺乳动物不同组织的适用性。研究人员分别在四种不同的小鼠组织类型上进行了测试,包括脑、肝、乳腺癌和肺(图3),并计算在长度为1500 μm的组织扩展后特征测量的均方根(RMS)长度测量误差来评估ProteomEx的各向同性。结果显示脑、肝、乳腺癌和肺组织样本的RMS误差分别为测量距离的~8%、~10%、~8%和~10%,使用DDA采集模式对每一种组织类型的~5 nL体积进行测试,在脑、肝和乳腺癌样本分别实现了 24,436/3540, 14,298/2606, 9623/2356 个多肽/蛋白质的鉴定量。
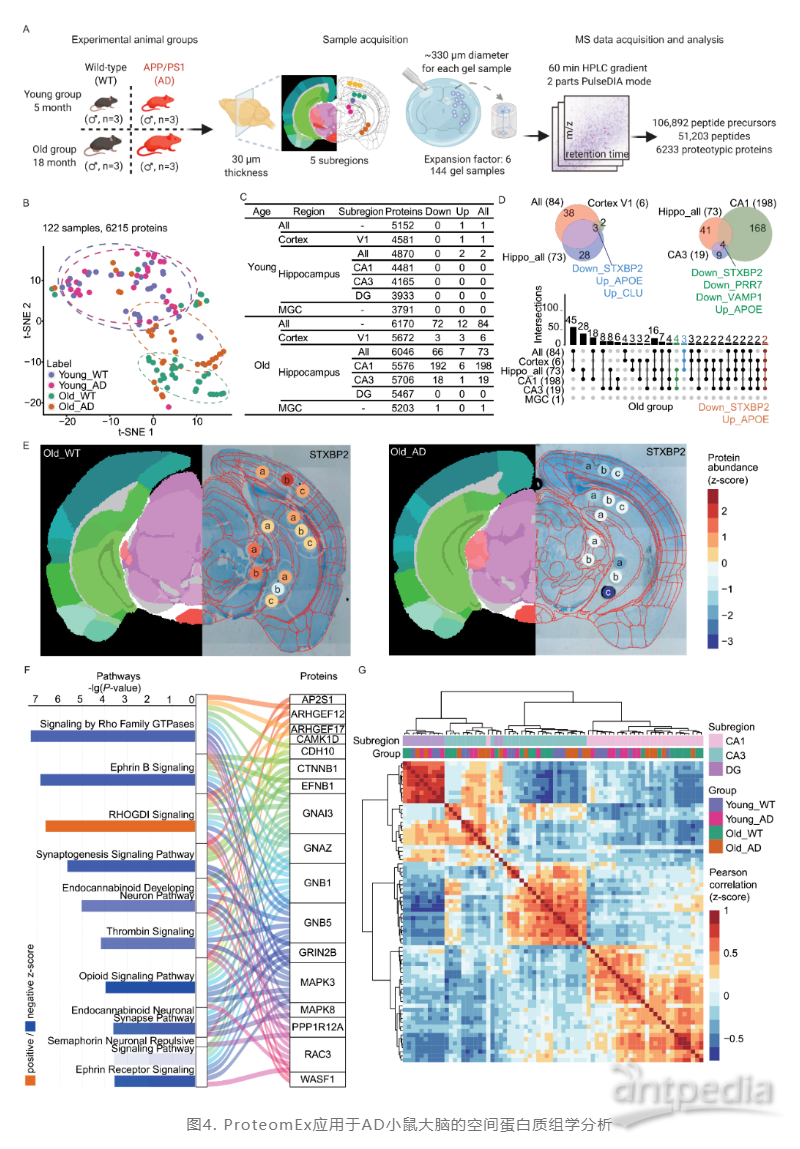
最后,研究团队使用ProteomEx技术应用于阿尔兹海默症模型及其对照小鼠的大脑研究(图4)。从皮质(V1)、海马区CA1(CA1)、海马区CA3(CA3)、齿状回(DG)和内侧膝状复合体(MGC)共获取了144个含有具体定位信息的样本,通过多肽提取及质谱分析,共鉴定到51,203条多肽,对应6233种蛋白。从全局蛋白组表达层面来看,年轻小鼠在疾病组与对照组差异并不显著。而在老年组的小鼠中,海马区差异蛋白最多,而相比之下,V1区只有6个差异蛋白,MGC区有1个差异蛋白。在对海马区的进一步亚区域水平解析上,相比于CA3和DG区域的变化,海马中的CA1在蛋白质组层面变化最明显,有198个差异蛋白,后续研究者们根据CA1中变化的蛋白种类与定量,重点探讨了其背后的生物学通路和功能变化。这些结果表明ProteomEx可以有效地研究阿尔兹海默症的病理异质性。
综上,ProteomEx技术为分析亚纳升体积的组织的空间蛋白质组学分析提供了一种简单实用的替代方法。由于ProteomEx类似于蛋白质保留扩展显微镜,它在未来可以与细胞结构的超分辨率显微镜以及DNA和RNA荧光原位杂交相结合,从而实现空间多组学方法。
西湖大学科研助理李璐(现浙江大学博士生,西湖大学访问学生,郭天南教授团队),西湖大学科研助理孙翠骥(KirylD.Piatkevich教授团队),西湖大学博士后孙耀庭(郭天南教授团队)、西湖大学博士后董振(郭天南教授团队)为本文共同第一作者,西湖实验室郭天南博士和Kiryl D. Piatkevich博士为本文共同通讯作者。该研究受到科技部重点研发项目、国家自然科学基金、西湖大学、西湖实验室的资助和支持。
自愈导电水凝胶的开发对于电活性神经组织工程至关重要。典型的导电材料如聚吡咯(PPy)通常用于制造人工神经导管。此外,组织工程领域已经朝着透明质酸(HA)水凝胶等产品的使用方向发展。尽管HA修饰的PPy......
每年数百万人遭受各种类型的创伤,包括意外创伤和手术切口造成的创伤。组织损伤后,大出血和伤口感染是导致死亡的主要原因。尽管缝合线和缝合钉是目前临床治疗中最常见的伤口闭合方法,但耗时的手术和苛刻的技术要求......
韩国浦项科技大学和抱川中文医科大学的一个联合研究小组,利用子宫衍生的脱细胞外基质(UdECM)研制出一种可诱导子宫内膜再生的水凝胶,并首次揭示了控制这一过程的机制。该项成果发表在3日的《先进功能材料》......
水凝胶具有类似于细胞外基质的理化性质,具备良好力学性能、自愈合能力和响应性,可用于构建组织再生的微纳米仿生结构,并提供微米尺度的表面形态来调节细胞行为,如细胞粘附、迁移或生存增殖分化因子的释放。因此,......
5月29日,记者从湖北工业大学获悉,该校材料与化学工程学院微纳米及软物质科研团队李学锋教授、黄以万副教授提出通过一种简单的二次平衡法,开发出一系列溶胀却力学性能增强的水凝胶材料,其力学性能优于许多已报......
机器人技术的发展一直是人类探索的热点话题,如何让机器人更像人类,不仅在外形上,还要在功能上,是许多科学家的追求。近日,剑桥大学的仿生机器人实验室的研究人员就取得了重要的进展,他们研发了一种基于水凝胶的......
英国剑桥大学生物启发机器人实验室的研究人员创造了一种新的基于水凝胶的皮肤,这种极其柔韧的皮肤使用一系列电极和一种算法重建触觉刺激,让机器人能够检测物体的触觉特性,复制人类的触觉,有望促进软体机器人的开......
邓炳耀团队受海洋生物贻贝在潮湿环境下超强黏附性的启发,将季铵盐壳聚糖、多巴胺、槲皮素等成分有机结合在一起,构建了一种兼具黏附性、自修复、抗氧化、抗菌等多种优异功能的复合水凝胶敷料。4月25日,科技日报......
中国科学技术大学工程科学学院微纳米工程实验室教授吴东、褚家如课题组,基于数字微镜阵列(DMD)系统,利用激光光场调制技术,制造出一种新颖的高性能自驱动水凝胶微马达,为微型旋转机械的设计与制造开拓了新方......
美国卡内基梅隆大学和中国香港中文大学的研究人员开发了一种能利用各种材料创建超高分辨率、复杂3D纳米结构的策略。研究成果近日发表在《科学》杂志上。研究团队此次开发的新技术,为微加工领域的长期挑战找到新的......