Sangamo Therapeutics公司的研究人员上周五在《Nature Communications》杂志上发表题为“Diversifying the Structure of Zinc Finger Nucleases for High-Precision Genome Editing”的文章,展示了其第二代的锌指核酸酶(ZFN)技术。
据Sangamo介绍,这些改进使得ZFN的多样性增加到64倍,从而有望对特定基因组位点进行高度精确的编辑。文章的通讯作者Edward J. Rebar博士是Sangamo的高级副总裁兼首席技术官,第一作者是David Paschon博士。
Paschon博士及其同事通过一系列蛋白质改造工作,开发出新的ZFN结构。这些改造包括颠倒DNA结合结构域和核酸酶结构域的顺序,以及运用新的接头(linker)跳过相邻锌指之间的碱基。通过这种结构多样化的策略,他们试图大幅度提高ZFN的靶向精确度。
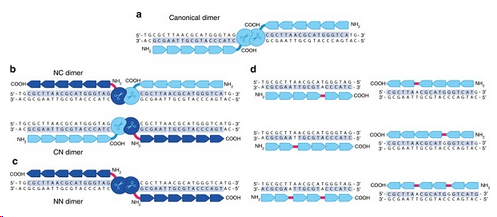
(图片来自原文,红色部分为接头)
研究人员开发出一系列新接头,能够跳过锌指-锌指以及锌指-FokI切割结构域之间的碱基。他们报道称,这些改造使得ZFN结构的数量增加到64倍,能够实现任意位点的靶向切割。他们还评估了30种新结构,确定其中97%为活性核酸酶。
“我们的研究表明,我们的接头元件能够与现有的锌指结合,以接近1.0的密度靶向任意基因组片段,也就是说,ZFN能够靶向几乎每一个碱基。同时我们还表明,这些结构改进有望显著提高ZFN的靶向精确度,”研究人员写道。
让ZFN更有吸引力
同为基因编辑技术,人们不免将ZFN与CRISPR进行比较。一直以来,人们对ZFN的批评包括与CRISPR相比成本太高、速度太慢,以及开发高质量基因编辑产品的门槛过高。为此,Sangamo一直致力于缩短ZFN的开发周期。
“这种新结构显著提高了我们的靶向能力,将确保我们能够靶向最佳序列窗口,实现治疗应用。这说明了我们ZFN基因组编辑技术的多功能性,”Rebar博士谈道。
“在开发治疗用的核酸酶时,关键要求是能够定位临床效果最佳的双链断裂。在许多情况下,这一考虑使得最佳切割目标只能限制在狭窄的窗口。因此,提高靶向精确度一直是人们长期关注的问题,”Rebar补充道。
此前一个月,Sangamo宣布了利用ZFN技术治疗粘多糖贮积症(MPS)的I/II期临床试验的中期结果。尽管研究证实了疗法的安全性以及关键酶的表达,但没有取得公司期望的效果。
“它的确在发挥作用,但不足以带来临床受益,”Sangamo的CEO Sandy Macrae说。这些中期结果导致Sangamo的股价大幅下跌,从12.02美元跌至8.31美元,之后才逐渐反弹。
为人们带来更多选择
在这项研究中,Sangamo的研究人员表示,他们开发出新的接头,能够将FokI核酸酶结构域与DNA结合锌指结构域的N端连接,而以往只能与锌指结构域的C端连接。据介绍,这种设计产生了三种替代的ZFN二聚体,让设计ZFN时的选择增加到四倍。
同时,新的接头也允许相邻锌指之间的碱基跳跃。这样,经过改造的锌指就能够与部分移位的DNA序列相结合,同时保留相同的切割位点。如此一来,人们的设计选择又增加到16倍。
“将这两项改进纳入我们的ZFN平台,使得在任何目标位点进行有效基因组编辑的ZFN设计选项增加到64倍,”研究人员报告称。他们表示,这些新型结构在三种治疗应用中表现出出色的效率、精确度和特异性。
未来,这种接头也有望应用在TALENs、FokI-dCas9和Cas9等碱基编辑器中,以改善这些系统的性能。
SangamoTherapeutics公司的研究人员上周五在《NatureCommunications》杂志上发表题为“DiversifyingtheStructureofZincFingerNucl......
SangamoTherapeutics公司的研究人员上周五在《NatureCommunications》杂志上发表题为“DiversifyingtheStructureofZincFingerNucl......
作为我国第二代极轨气象卫星的第四颗卫星,风云三号D星于上个月成功发射。至此,我国已成功发射16颗气象卫星,也因此成为世界上在轨气象卫星数量最多、种类最全的国家之一。作为我国第二代极轨气象卫星的第四颗卫......
日前,由中国农业科学院农产品加工研究所(以下简称加工所)和北京市海乐达食品有限公司(以下简称海乐达)产学研合作开发的第二代马铃薯馒头类主食正式上市。加工所薯类加工研究团队通过配方优化、工艺参数改良以及......
科学网讯(记者成舸)4月23日上午,我国首例供胚移植试管婴儿、28岁的罗优群接到了当年把他从实验室带到人间的卢光琇教授亲手送来的万元大红包,祝贺他当上父亲。20日晚22时20分,罗优群的爱人经自然怀孕......