德国 KNAUER 碰撞喷射混合器(IJM)
BioNTech/Pfizer COVID-19 疫苗所有生产工厂均采用本套设备。
更多详细资料请联系:刘先生 15201316651(微信同号)
新冠疫情的持续凸显了疫苗的重要性以及全球对疫苗的迫切需求。借此契机,mRNA疫苗登上了舞台,并以极高的保护率成为所有新冠疫苗种类中热度最高的C位选择。本报告介绍分析了mRNA疫苗相较于其他技术路径疫苗的优势,mRNA疫苗的核心技术,以及未来的发展空间和方向。
前言
mRNA疫苗:疫苗行业新王朝的崛起
免疫系统及疫苗工作原理
免疫系统概览
获得性免疫作用原理
疫苗一般性原理
mRNA疫苗
mRNA疫苗相较于其他技术路径疫苗的优劣势分析
mRNA新冠疫苗临床数据解析:No pain, no gain
mRNA疫苗展现了令人振奋的保护率
mRNA疫苗不良反应:短期反应略高于传统疫苗,需要时间验证长期安全性
mRNA疫苗临床数据特点:No pain,No gain
mRNA疫苗严重/致命性不良反应罕见但需关注
新冠疫情为mRNA疫苗登上舞台带来机遇
mRNA疫苗效果初显,免疫屏障减缓病例新增
短期:国产mRNA疫苗应聚焦海外放量
中长期:病毒变异或削弱一代疫苗效力,mRNA疫苗可快速反应应对变异
mRNA疫苗生产流程
第一步:DNA质粒制备
第二步:体外转录
第三步:递送系统装载
第四步:灌装检验
mRNA疫苗两大核心竞争力:序列结构、递送系统
mRNA序列结构决定抗原蛋白结构、免疫原性及稳定性
递送系统是目前产能扩张的瓶颈
mRNA疫苗有望为肿瘤免疫疾病控制带来新曙光
mRNA疫苗属性契合肿瘤免疫疾病控制需求
mRNA疫苗能够激发针对细胞的T细胞免疫
mRNA疫苗能够更精准地靶向特异免疫目标
mRNA肿瘤疫苗研发情况
辉瑞mRNA疫苗CNN报道
mRNA疫苗:疫苗行业新王朝的崛起
2020年初,一场突如起来的传染病大流行给全世界带来了巨大变数。拥有与18年前“非典”罪魁祸首SARS病毒相似的部分结构,新型冠状病毒(SARS-CoV-2)甚至拥有了更强大的传染能力和应对温度变化的能力。全球每月新增病例数一路走高,春夏秋冬的自然变化对病毒几乎无影响。在此情况下,人类把终结这一疫情大流行的唯一希望寄托在疫苗的出世。各国医疗机构、企业纷纷投入这一领域中。新冠疫苗研发既让企业履行了社会责任,同时也给予企业巨大的市场空间。全球总人口超过77亿,建立起全球性的免疫屏障需要百亿剂以上的新冠疫苗。在此双重激励下,全球涌现出许多优秀的疫苗企业,以中美德三国为领导者,在1年内用前所未有的速度研制出相应的新冠疫苗,让深陷疫情泥潭的世界看到了曙光。而这些优秀的疫苗中,刚刚登上舞台便最为闪耀的一个品种是mRNA疫苗。
mRNA疫苗打破了传统灭活、减毒疫苗的免疫激活模式,创新性地利用人体本身细胞生产抗原,以此激活特异免疫。mRNA疫苗具有极高的有效保护率,同时相较于其他创新型疫苗(如:DNA疫苗、病毒载体疫苗)具有更高的安全性。在研发上,mRNA疫苗能够快速地更新迭代以应对不断出现的变异毒株。由于mRNA疫苗不需进行体外转译,因此生产过程也有所缩短,仅需要60-70天。
美国疫情的好转印证了mRNA疫苗的有效性。自美国总统拜登签署“百日疫苗接种计划”后,美国每日新增病例显著下降。
国内第一轮疫苗接种已接近尾声,短期内疫苗需求落至低点,但海外疫情持续蔓延,市场机会可观。长期来看,随着灭活疫苗有效期临近以及病毒变异加速,在2021年底2022年初国内可能会出现第二轮疫苗需求的高峰。
mRNA的应用前景非常广阔。除了能够用于预防传染性疾病,mRNA疫苗也为治疗肿瘤、免疫疾病带来了新的星火。在新冠疫情前,国际mRNA厂商的研究重点集中在肿瘤的治疗上。目前国际mRNA疫苗三巨头为:BioNTech、CureVac、Moderna,均布局了多条针对肿瘤的管线。除传染病和肿瘤免疫疾病外,mRNA疫苗在许多基因相关的疾病中都有开发潜能。在后新冠疫情时代,mRNA疫苗仍旧具备大幅增长的潜力。
mRNA疫苗的技术壁垒在于序列设计和递送系统。序列设计需要公司拥有大量长期的数据积累,不断训练优化平台。优秀的序列设计能够提高mRNA在体内的留存和作用时间,降低免疫原性,使mRNA序列更高效地表达抗原蛋白。递送系统则是mRNA的运载火箭,负责将mRNA成分完整地运送至目标靶点,并且在合适的时机和环境条件下及时释放。同时,递送载体需要经过人体免疫系统的层层保护,容易引起过敏等免疫反应,伤害疫苗的安全性。递送系统还很大程度决定了mRNA疫苗的储藏条件和储藏时限。目前拥有此技术的公司非常稀少,同时具有ZL保护壁垒,是mRNA疫苗行业“卡脖子”的技术之一。
艾博生物、斯微生物是国产mRNA疫苗进展最快的两家企业,除此之外,复星医药获得了BioNTech新冠疫苗大中华区的代理,mRNA新冠疫苗能否为公司创造盈利值得持续关注。
免疫系统概览
人体免疫系统是一个以功能作为定义的系统,而非由器官作为定义的系统。其中包含皮肤、黏膜等物理屏障,肝脏等器官分泌的蛋白化学物质,也包括巨噬细胞、T细胞等生物类保护分子。
免疫系统可分为固有性和获得性免疫。
固有性免疫是人体天生带有的免疫系统,具有非特异性、反应快速等特点。获得性免疫则具有特异性,在首次感染时反应较慢。
一般情况下,抵御外源性入侵物质的第一道防线是固有性免疫。固有免疫中又可分为外部防御和内部防御。外部防御的典型是皮肤以及黏膜,是人体整套防御系统的排头兵。若外部防御被突破,内部防御将筑起第二道防线,其中包括吞噬细胞、抗微生物蛋白质、自然杀手细胞(NKcell)等。
若固有免疫无法成功防御入侵,获得性免疫则会启动。由于获得性免疫具有特异性,因此针对特定入侵物质的防御效果较为明显。常见的获得性免疫可分为体液免疫和细胞免疫。目前,几乎所有疫苗的最终目的都是激活此处所提到的获得性免疫。
获得性免疫作用原理
如其名,获得性免疫指后天得到的免疫。具体可分为体液免疫和细胞免疫。
体液免疫的核心细胞是B细胞(B cell)。原始B细胞在接触到外源性抗原后便被激活,并根据抗原成长分化为特异性B细胞,开始分泌特异性抗体。抗体能够识别入侵病原体表面的抗原,并与其结合。抗体本身没有杀死病原体的物质,但它能够与病原体结合使其失去感染其他细胞的能力,同时引导其他免疫细胞,例如巨噬细胞,将病原体吞噬,一些抗体能加速病原体细胞的分解。根据克隆选择理论(thecolonal selection theory),病原体被杀灭后,特异化B细胞会继续留在体内,成为免疫系统的一段“记忆”。若再次遇到相同抗原时,留存的B细胞便能快速扩增、分泌抗体,而不需重新从原始B细胞开始分化。因此,首次感染时,B细胞特异免疫反应较慢;而后二次感染时,B细胞特异免疫反应速度则非常迅速。同时,由于特异性B细胞会留存于体内,抗原出现频率越频繁,针对此抗原的特异性B细胞扩增数量越多,因此,特异免疫的反应也会越来越快越来越强。这是许多疫苗需要多剂次加强的原因。
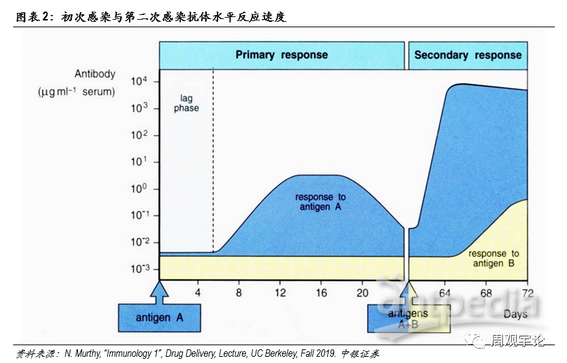
细胞主导免疫的核心细胞是T细胞(T cell)。T细胞分为2类:辅助T细胞(CD4+)和杀手T细胞(CD8+)。当外源性蛋白质进入体内,部分蛋白会被抗原呈递细胞(Antigen Presenbting Cell,APC)捕捉。常见的APC包括树突细胞(DendriticCell,DC)、B细胞等。APC通过TLR(Toll-Like Receptor)分辨是否是外来抗原。若识别结果为外来抗原,APC会将抗原片段以抗原-MHC结合体的形式暴露在APC细胞膜表面。当辅助T细胞的受体(TCR)与MHC-抗原结合时,辅助T细胞会开始复制并释放细胞素,激活B细胞和杀手T细胞。杀手T细胞被激活后通过MHC结构与APC结合,并释放穿孔素和颗粒酶。穿孔素会附着在目标细胞膜上形成穿孔,颗粒酶通过穿孔进入细胞内部溶解细胞。当病原体消灭后,部分CD4+和CD8+T细胞会继续留在体内,称为记忆T细胞。与记忆B细胞类似,记忆T细胞拥有对抗原的特异性。若未来遭遇相同的外来抗原,T细胞能够迅速扩增激活,杀灭入侵的病原体。
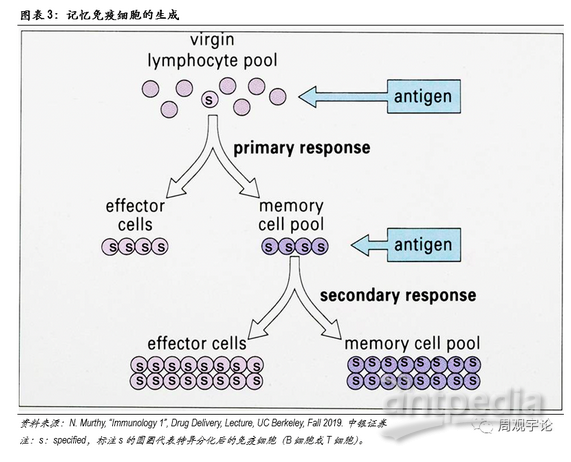
总体而言,获得性免疫的激发来源于对抗原的识别。当某一病原体首次入侵时时,由于没有现成的特异化B细胞和T细胞,获得性免疫的应答时间较长。原始B细胞和T细胞需要时间分化形成特异性免疫细胞。在完成首次杀灭后,部分特异化的B细胞和T细胞会留存于体内成为记忆B细胞、记忆T细胞。若未来再次遭遇相同抗原入侵,无需原始B/T细胞重新分化,记忆B细胞和T细胞将自我扩增、激活,迅速启动免疫应答。
疫苗一般性原理
疫苗的目的是让人体形成特异性的记忆B细胞和记忆T细胞。在免疫记忆形成后,若人体遭到此病原体袭击,获得性免疫能够迅速应答,在病原体大规模感染其他细胞前,将病原体和已被感染的细胞杀灭。
目前,绝大部分疫苗的逻辑是通过递送抗原,使人体自发形成特异性免疫反应。相较于直接注射抗体或特异性T细胞,人体自发形成的免疫具有更好的持续性,同时免疫原性更低。直接注射的外源性抗体或T细胞本质上也属于外来物质,在人体内容易遭受免疫系统攻击。同时,抗体和T细胞本身具有半衰期,免疫有效时间短。由于直接注射的抗体或T细胞无法成为人体免疫记忆的一部分,因此,人体不能直接复制注射进入的抗体或T细胞,所以无法在遭遇抗原时快速扩增,免疫反应较弱。
直接递送抗体或T细胞的做法不适用于预防领域,但在部分治疗领域能够发挥作用。目前关注度较高的抗体药便是将人为制造或编辑的抗体导入人体内,直接由注入的抗体对特定细胞进行杀伤或抑制。CAR-T疗法则是直接递送经过人为编辑的T细胞(称为CAR-T细胞)进入体内,由这部分改装过的CAR-T细胞直接杀伤目标细胞(例如肿瘤细胞)。
疫苗通过递送抗原激发人体特异性免疫反应。但与自然界中病原体入侵形成免疫记忆不同,疫苗往往只递送无毒无害的某一抗原片段进入人体。抗原本身是无害的,可视作一种标识,供免疫细胞进行识别。因此,疫苗本身并不带有毒性。
mRNA疫苗
mRNA疫苗是一种核酸疫苗,通过将病毒的部分mRNA片段注入人体细胞内产生抗原,再由此激发特异性免疫反应,达到形成免疫记忆的效果。
mRNA疫苗治疗原理:“巧”用自身细胞加强特异性免疫
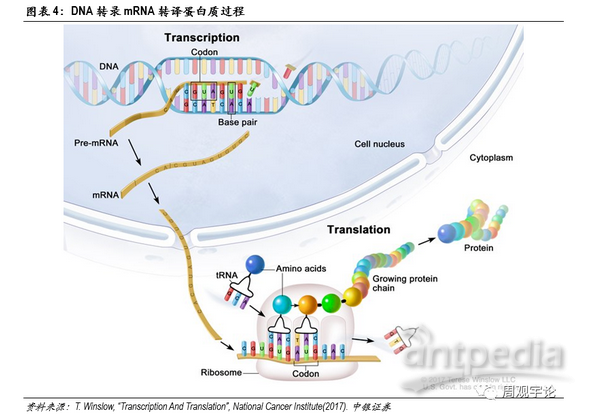
DNA是存储人体遗传信息的载体。人体内绝大部分细胞都带有DNA。但是DNA本身无法直接对人体产生影响,各类蛋白质才是能够左右表象的物质(例如:抗原、激素)。DNA需要转化为蛋白质才能够将遗传信息表达出来。整个DNA转化为蛋白质的过程分为两大步,第一步:DNA转化为mRNA,这一步骤称为转录(transcription),发生在细胞核内;第二步:mRNA转化为蛋白质,这一步骤称为转译(translation),发生在细胞质中。可以看到,mRNA是DNA转化为蛋白质的中间体,这也是它名称的由来,即信使RNA(messenger RNA)。通俗来讲,DNA类似于底稿,DNA发生的改变会一直存在于体内,由此细胞分裂新产生的细胞也会继承这些改变,因此DNA的改变有很大概率会伴随一生,其中性细胞中DNA的变化甚至能够遗传至下一代。mRNA类似于说明书,能够指导自身细胞生产出特定的蛋白,但是mRNA的改变不会被分裂产生的新细胞继承,也不会遗传至下一代个体中。蛋白则是最终生产得到的工具,对生物个体的各项指标直接产生作用。同样地,蛋白不会被继承或遗传。这一条转录转译链被称为生物学“中心法则”。mRNA疫苗利用了两步表达的机理,使疫苗在不改变DNA序列的同时,为人体免疫系统的激活提供更准确的抗原蛋白以及更持久的抗原体内留存时间,使被激活的特异性免疫更精准,同时免疫效果得到巩固。
具体来分析mRNA新冠疫苗的机理。mRNA疫苗中的mRNA片段编码新冠病毒表面的某些蛋白或受体,例如刺突蛋白(S蛋白)。疫苗递送人工编辑后的mRNA进入人体细胞,在体内“借用”人体自身细胞转译mRNA为蛋白质。此类mRNA在经过转译后会表达成为病毒所具有的某种抗原蛋白。虽然产生的抗原是由自身细胞制造,但由于其氨基酸序列具有外源性,APC中的TLR并不识别此段序列,因此仍旧会激发B细胞和T细胞针对此抗原蛋白的特异性免疫反应,并建立免疫记忆。
LNP递送系统:递送疫苗有效物质进入预定轨道的运载火箭
如今,病毒遗传信息序列的解码和反向序列合成已不是难题。如何将合成好的mRNA序列递送进入人体细胞变成了mRNA疫苗研发的重要挑战之一。
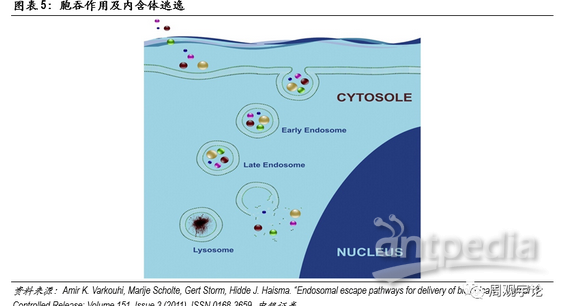
人体细胞结构从外至内可分为细胞膜(cellmembrane)、细胞质(cytoplasm)、细胞核(nucleus)。mRNA转译成蛋白质的过程发生在细胞质中,因此,mRNA疫苗要发挥作用,必须先将编辑好的mRNA转递进细胞质中。进入细胞质需要通过细胞膜,细胞膜由磷脂双分子层构成,磷脂分子头部具有亲水性,尾部具有疏水性,两层磷脂尾部相对形成双分子层,能够有效控制水分子、离子、大分子物质通过。mRNA作为大分子(300-5000kDa),在不破坏细胞膜的前提下,进出细胞只能以内含体(endosome)通过胞吞作用(endocytosis)。通常情况下,内含体进入细胞质后,会被直接送至溶酶体(lysosome)进行分解。为保证mRNA在转译前保持完整性,mRNA需要在内含体与溶酶体结合前打破内含体包膜(endosomaldisruption)并逃离。逃离内含体进入细胞质后,mRNA便会在细胞质内游动,直至到达核糖体(ribosome)并在此转译为肽链,最终折叠成为蛋白质。
对于mRNA疫苗和药物,递送系统有两大职责:一是有效包裹和保护mRNA在到达靶点前维持稳定,二是帮助mRNA有效成分进入细胞,三是在mRNA到达溶酶体前将其释放进入细胞质中。
LNP是目前最具潜力的递送载体之一。LNP(Lipid Nanoparticle)是脂质微粒的总称,其中又包括脂质胶团(micelle)、脂质体(liposome)等。LNP与细胞膜的组成成分相似,均由脂质分子构成。脂质分子的两条长尾通常呈平行状态,在此状态下,脂质形成的双分子层稳定。在进入细胞质酸性环境后,部分脂质的头部质子化,呈现阳离子形态,与其他阴性离子态的脂质分子相吸引,尾部张开。原本双分子层的形式被破坏,形成头部聚集在一起的环状。之前包裹在内的mRNA便可逃逸出内含体,进入细胞质等待转译。
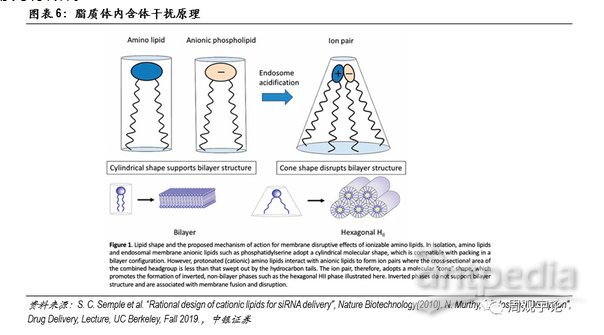
为了提高载体对包裹成分的保护能力,通过在载体外部连接PEG可以进一步增强载体的稳定性。
mRNA疫苗相较于其他技术路径疫苗的优劣势分析
(1)mRNA疫苗 vs. 灭活疫苗:具有明显的免疫保护力优势
与传统灭活疫苗、裂解疫苗相比,mRNA疫苗激活特异免疫的路径不相同。传统疫苗激活特异性免疫的方式是直接将抗原蛋白注射进入人体,引起免疫反应;而mRNA是将编码病毒抗原的mRNA注入体内,由人体自身细胞产生对应的抗原,以此激活特异性免疫。理论分析,mRNA疫苗能够呈现更多的抗原,同时能更持久地激活巩固特异性免疫。原因在于,传统灭活疫苗的抗原呈递数量是一定的,即最终到达体内引起免疫反应的抗原数量只能够小于或等于疫苗中含有的抗原数量。同时,灭活疫苗呈递抗原的过程是一次性的,注射时疫苗呈递的抗原即为所有抗原,这些抗原的降解时长即为持续激活免疫的时长,此后不会有新增抗原。而mRNA疫苗抗原呈递的过程是可短暂持续的,呈递的mRNA可指导多个核糖体产生抗原蛋白,直至mRNA 降解。由于细胞能够不断根据mRNA生产抗原蛋白,因此抗原数量受疫苗剂量所限制较小,从时间维度上看,抗原不会在短时间内迅速被消耗完毕。抗原数量水平越高、保持时长越长,形成的特异性免疫记忆越强烈,免疫应答更快、持续时间越长。
(2)mRNA疫苗 vs. DNA疫苗:更高效,逆转录风险较小
与核酸疫苗中另一路径的DNA疫苗相比,mRNA疫苗更有效也更安全。DNA疫苗需要将包裹的有效成分递送通过两层屏障:细胞膜和细胞核膜,最终进入细胞核内开始抗原蛋白的表达。多层屏障导致有效成分难以进入反应场所,免疫激活更难。同时,由于DNA疫苗呈递的有效成分需要进入细胞核内,导致外源遗传片段逆转录进入人体DNA的概率增加,引起肿瘤癌症的概率增加。相较而言,由于mRNA疫苗导入的外源物质不需进入细胞核,发生外源遗传片段逆转录进入人体自身DNA的概率较小,因此引起肿瘤癌症的概率极小。
(3)mRNA疫苗 vs. 病毒载体疫苗:适用人群覆盖全面,逆转录风险较小,机会成本更低
LNP为递送mRNA片段到达靶点、定点释放提供了支持。另一大受到较高关注度的载体平台是病毒载体平台,常见的类别有腺病毒(Adenovirus)、腺相关病毒(Adeno-Associated Virus,AAV)、慢病毒(lentivirus)。病毒载体通过去除病毒本身的有害物质,保留感染能力,将目标物质递送进入细胞内,由细胞产生抗原蛋白,进而引起特异性免疫反应。病毒载体反应的一大缺陷是,若接种者本身体内含有针对此病毒载体的抗体(如腺病毒、AAV、慢病毒,而非针对目标抗原的抗体),或在短时间内快速产生了抗体,则病毒载体疫苗无法将有效成分递送进入预定的细胞质内。相比之下,LNP的结构由脂质分子构成,载体引起免疫反应的几率较小,能够更有效地递送有效成分至目标靶点。除此之外,部分病毒平台有发生逆转录的概率,会将外源基因整合进入人体DNA中,可能导致肿瘤、免疫疾病等。同时,病毒载体疫苗具有更高的机会成本。当人体接受病毒载体疫苗注射后,体内会自动产生针对此载体的抗体和其他特异免疫反应。此后再次运用相同或相似病毒载体作为递送系统给药时(例如一些肿瘤治疗药物),会更容易遭到免疫系统的攻击,难以成功将药物递送至靶点。
mRNA疫苗的临床运用历史始于2020年新冠疫情。根据WHO数据,截止2021年5月7日,全球共有15款mRNA疫苗在研,其中包括已纳入WHO紧急使用名单(Emergency Use Listing,EUL)的2款mRNA疫苗:由辉瑞/BioNTech联合研发的BNT162b2,以及由Moderna研发的mRNA-1273。
mRNA疫苗展现了令人振奋的保护率
2020年11月18日,辉瑞发布了BNT162b2的III期临床试验结果,结果显示疫苗整体保护率高达95%。2021年3月31日,Moderna发布了mRNA-1273的III期临床试验结果,结果显示疫苗整体保护率也达到94.1%,与BNT162b2的数据非常接近。2款mRNA疫苗同时展现出极为优异的保护率,共同预示着mRNA疫苗技术在激活免疫系统上的令人震惊的高效,也让科学界对mRNA疫苗技术未来在其他疾病领域可能带来的改变充满期待。同时,mRNA疫苗在65岁及以上的老年群体中,仍能高效地激发免疫反应,保护率稳定在高水平。
(1)辉瑞/BioNTech mRNA疫苗(BNT162b2)有效性
临床试验数据分为两部分。第一部分,样本人群为在实验前或实验开始时均未感染新冠病毒的人群,本样本人群共有36523人,其中疫苗组18198人,均接受2剂BNT162b2注射;另外18325人为安慰剂组,接受2剂安慰剂注射。在完成2剂接种7天后,疫苗组出现8例新冠感染者,安慰剂组出现162例,疫苗有效保护率达到95.0%。
第二部分样本人群包括感染和未感染新冠病毒的人群。样本人数40137人,其中疫苗组19965人,安慰剂组 18325人。在完成2剂接种7天后,疫苗组中出现9例新冠感染者,安慰剂组169例。疫苗有效保护率达到94.6%。
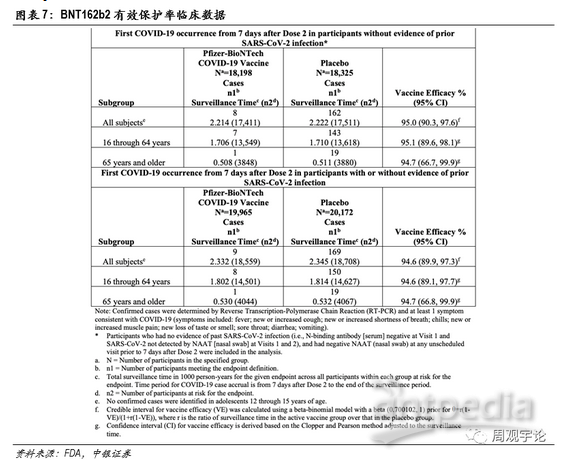
根据年龄段划分,BNT162b2对16-64岁人群的保护率为95.1%,对65岁及以上的老年群体保护率则维持在了94.7%。数据显示了mRNA疫苗在人群中激活免疫系统的能力基本不受接种者年龄的影响。
(2)Moderna mRNA疫苗(mRNA-1273)有效性
全球领先上市的另一款mRNA新冠疫苗是Moderna公司与美国国家过敏及传染疾病研究所(NIAID)研发的mRNA-1273。这款疫苗的技术路径与辉瑞/BioNTech的mRNA疫苗相同,临床结果也展现了令人振奋的保护率,以及较低的不良反应发生概率。
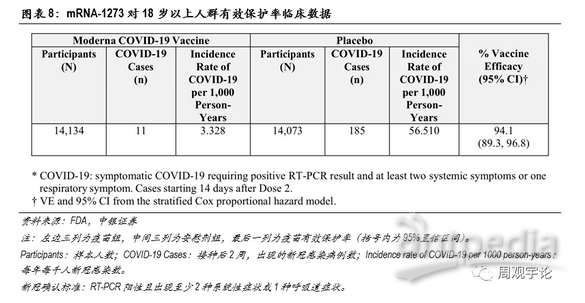
根据Moderna公司给医疗服务机构的事实陈述,mRNA-1273的保护率达到约94.1%(95%CI:89.3%-96.8%)。
在针对18岁以上人群的临床试验中,科学家将样本人群分为两组:疫苗组14134人,均接受2剂mRNA-1273注射;另外14073人为安慰剂组,接受安慰剂注射。在完成第2剂接种14天后,疫苗组中出现新冠病例11例,每年每千人病例数为3.328;安慰剂对照组中出现新冠病例185例,每年每千人病例数为56.510。由此测得,疫苗保护率约为94.1%,与辉瑞/BioNTech的mRNA新冠疫苗临床有效率非常相近。Moderna和辉瑞/BioNTech mRNA疫苗的临床实验结果都显示出采用mRNA技术路径的疫苗具有极高的有效性。
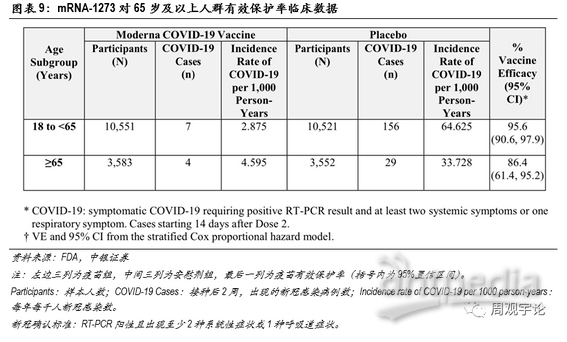
本次临床试验的样本人群中包含了65岁及以上的老年人群,疫苗组中有3583位老年人,其中出现4例新冠感染;安慰剂组中有3552位老年人,其中出现29例新冠感染。因此,mRNA-1273对于65岁及以上的人群的有效保护率为86.4%,表现仍旧非常优秀。
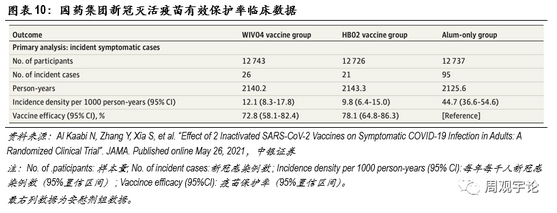
(3)国药集团灭活疫苗(WIV04/HB02)有效性
为了更直观地展现mRNA疫苗与传统疫苗在不同指标上的差别,我们在此引用使用最为广泛的灭活型疫苗进行对比。国药集团及北京生物研究所、武汉生物研究所共同研发的WIV04和HB02是2款最先上市的传统灭活疫苗。
2021年5月26日,JAMA发布了国药集团2款灭活新冠疫苗的临床III期结果。临床结果展现了不错的保护率,整体保护率均在70%以上,远远超出了世界卫生组织50%的要求。
具体数据如下:接种WIV04 的12743人中,出现26例新冠感染;接种HB02的12726人中,出现21例新冠感染;安慰剂组共12737人,出现95例新冠感染。由此可计算得到WIV04的保护率为72.8%(95%CI:58.1-82.4),HB02的保护率为78.1%(95%CI:64.8-86.3)。2款灭活疫苗整体保护率相近,但是与2款mRNA疫苗>90%的保护率相比,仍旧略逊一筹。
mRNA疫苗不良反应:短期反应略高于传统疫苗,需要时间验证长期安全性
除了有效保护率外,疫苗的另一重要指标是不良反应发生的种类和概率。总体来说,灭活疫苗因其成熟的技术和研发生产经验,不良反应发生频率较低,反应程度也较为温和。mRNA疫苗则运用了全新的技术,目前得到的安全数据只反映了接种后短期内可能发生的不良反应,是否会对人体造成长期的影响还需要时间进行长期的观察。
从理论分析,mRNA疫苗通过使部分人体细胞表达外源抗原来激活免疫,除了抗原本身会引起免疫反应,这部分表达抗原的自体细胞可能也会引起较强烈的免疫反应。灭活疫苗则是直接呈递抗原,因此免疫反应较小。
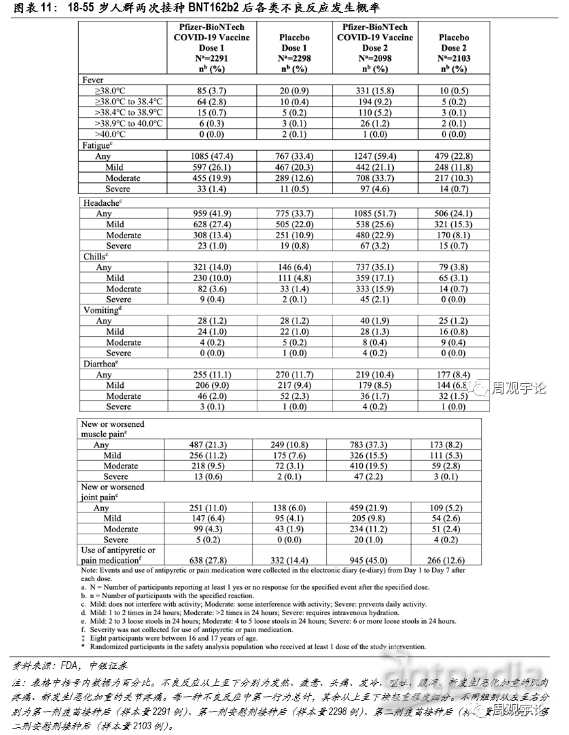
(1)辉瑞/BioNTech mRNA疫苗(BNT162b2)安全性
临床试验记录了样本人群每剂次接种后7天以内的不良反应,并将样本人群分为3个年龄阶段:12-15岁、18-55岁、56岁及以上,以研究疫苗对青少年和老年人是否安全。总体来说,第二次接种后绝大多数各类不良反应出现的概率均高于第一次接种后。局部不良反应中,注射处疼痛报告比例较高,第一次、第二次接种后报告疼痛的比例为83.1%、77.8%(对应安慰剂组14.0%、11.7%),其中严重疼痛以致于无法进行日常活动的比例为1.0%、1.2%(对应安慰剂组0.1%、0.0%)。系统性不良反应中报告最多的是头痛和疲惫。在18-55岁主要年龄层的研究中,第一次接种后头痛和疲惫的出现几率分别为41.9%、47.4%(对应安慰剂组33.7%、33.4%),第二次接种后的几率分别为51.7%、59.4%(对应安慰剂组24.1%、22.8%)。其他不良反应中,接种第一剂疫苗后,呕吐、腹泻出现的概率分别为1.2%、11.1%,但安慰剂组的对应概率也分别达到1.2%、11.7%,不良反应出现概率与疫苗组持平甚至更高,因此无法判断此类不良反应的出现是否和疫苗接种有因果关系。相较于第一剂接种,第二剂接种后出现不良反应的概率要更高,出现发热的频率达到15.8%(对应安慰剂组0.5%),发冷、肌肉疼痛和关节疼痛的出现频率也较高,分别为35.1%(对应安慰剂组3.8%)、37.3%(对应安慰剂组8.2%)、21.9%(对应安慰剂组5.2%)。
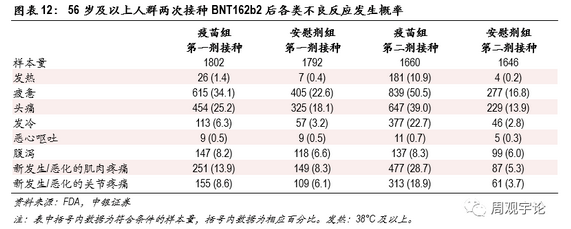
56岁及以上人群接种疫苗后不良反应的发生频率并未显示出疫苗会对老年群体造成更严重的副作用,老年人群报告的不良反应发生频率甚至略低于18-55岁年龄段的水平。不同种类的不良反应发生规律与18-55岁年龄层类似,头疼和疲惫的发生频率较高。
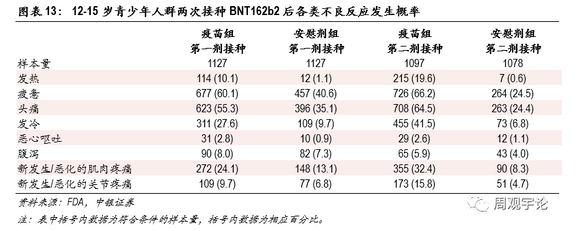
12-15岁年龄层人群接种疫苗后不良反应的发生规律与其他两个年龄层相似,不良反应发生概率略高于其他两个年龄层。12-15岁年龄层人群接种疫苗后出现发热的概率较高。接种第一剂后的发热概率为10.1%(对应安慰剂组1.1%),接种第二剂后的发热概率为19.6%(对应安慰剂组0.6%)。
根据CDC数据,截至2021年1月18日,接种BNT162b2疫苗后引起的过敏反应在每百万人中仅出现5例,概率极低。
(2)Moderna mRNA疫苗(mRNA-1273)安全性
Moderna mRNA-1273的临床不良反应研究记录了每剂次接种后7天以内的不良反应,将样本人群分为2个年龄阶段:18-64岁、65岁及以上,同时每个年龄层中分为疫苗组和安慰剂组。总体来说,第二次接种后绝大多数各类不良反应出现的概率均高于第一次接种后。
局部不良反应中,疼痛仍旧是占比最高的,第一次和第二次接种后报告疼痛的比例分别为86.9%、89.9%(对应安慰剂组19.1%、18.7%)。其中三级疼痛报告比例分别为3.2%、4.6%(对应安慰剂组0.2%、0.2%)。
系统性不良反应中,疲惫报告比例仍旧最高,第一次和第二次接种后报告疲惫的比例分别为38.4%、67.6%(对应安慰剂组28.8%、24.6%),与BNT162b2数据相近。
不良反应种类中,除注射处疼痛外,报告最多的不良反应是头痛和疲惫。在18-55岁主要年龄层的研究中,第一次接种后头痛和疲惫的出现几率分别为41.9%、47.4%(对应安慰剂组33.7%、33.4%),第二次接种后的几率分别为51.7%、59.4%(对应安慰剂组24.1%、22.8%)。其他不良反应中,接种第一剂疫苗后,呕吐、腹泻出现的概率分别为1.2%、11.1%,但安慰剂组的对应概率也分别达到1.2%、11.7%,不良反应出现概率与疫苗组持平甚至更高,因此无法判断此类不良反应的出现是否和疫苗接种有因果关系。相较于第一剂接种,第二剂接种后出现不良反应的概率要更高,出现发热的频率达到15.8%(对应安慰剂组0.5%),发冷、肌肉疼痛和关节疼痛的出现频率也较高,分别为35.1%(对应安慰剂组3.8%)、37.3%(对应安慰剂组8.2%)、21.9%(对应安慰剂组5.2%)。
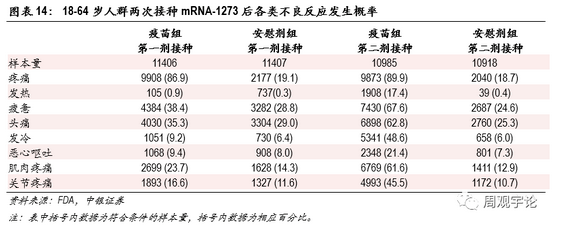
65岁及以上人群接种疫苗后不良反应的发生规律与18-64岁年龄层类似,局部不良反应中疼痛的出现频率较高,第一次和第二次注射后出现概率分别为74.0%、83.2%(对应安慰剂组12.8%、12.0%)。系统性反应中,头疼和疲惫的发生频率较高。第二剂接种后,发热、发冷、肌肉关节疼痛等不良反应出现概率较第一剂接种后数据上升较为明显。
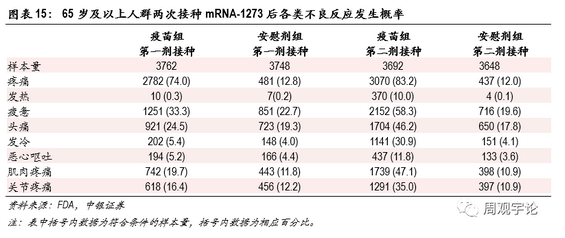
2款mRNA疫苗的III期临床试验不良反应数据方面接近,局部反应中疼痛最为普遍,在主要人群中第一剂次和第二剂次平均出现概率为82.4%、85.0%(对应安慰剂组16.3%、15.6%)。系统性不良反应中疲惫与头痛出现比例较高,在18岁及以上人群接种第二剂次后,疲惫与头痛的报告比例分别为,三级及以上疲惫的出现概率平均为7.68%(对应安慰剂组0.67%),三级及以上头痛的出现概率为3.99%(对应安慰剂组0.99%)。
(3)国药集团灭活疫苗(WIV04/HB02)安全性
传统疫苗例如灭活疫苗相较而言较为安全,不良反应出现频率低。灭活疫苗采用的技术路径相对简易,外源物质不需要进入细胞(mRNA需要进入细胞质),因此激发的免疫反应较温和。从临床数据来看,灭活疫苗这一技术路径已经过长期不同种类疫苗的验证,并未发现长期对人体有负面影响。
由于统计标准不同,从国药集团2款灭活疫苗的III期临床数据中,我们摘取了第一剂接种后0-28天内(期间部分样本人群接种了第二剂疫苗)发生的不良反应报告。发生最普遍的仍旧是疼痛,平均发生频率为21.8%(对应安慰剂组27.9%),显著低于mRNA疫苗80%左右(对应安慰剂组15%左右)的水平,并且疫苗组数据小于对照组数据。系统性不良反应中,报告频率较高的是疲惫与头痛,分别为11.3%、13.4%(对应安慰剂组10.8%、13.0%),其中三级疲惫与头痛报告比例分别为1.1%、1.0%(对应安慰剂组<0.1%、<0.1%),显著低于mRNA疫苗数据。
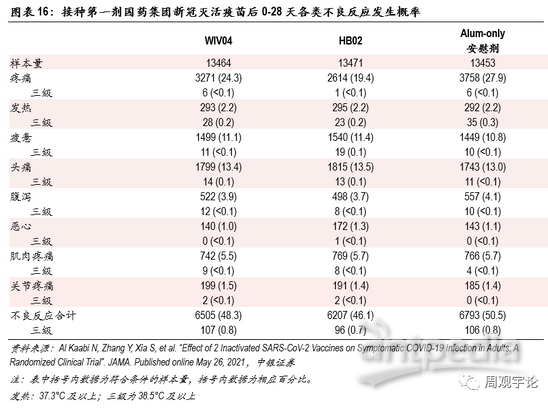
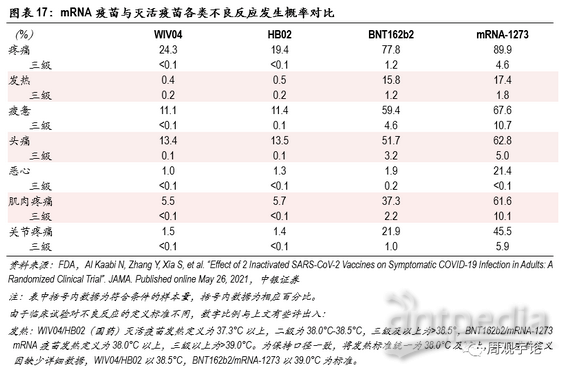
从不良反应发生比例来看,灭活疫苗接种后短期内各项不良反应发生比例明显低于mRNA疫苗。虽然三款疫苗临床试验对于不良反应的定义不同,对照组不同,数据收集周期有差别,但数据上巨大的差异仍能或多或少地体现出mRNA疫苗会带来较多较强烈的不适。发热,作为能够进行横向量化对比的不良反应之一,在接种mRNA疫苗后出现频率远远高于接种灭活疫苗后的频率。接种灭活疫苗后发热(38.0°C以上)的发生比例平均为0.4%,38.5°C以上的发生比例为0.2%;接种mRNA疫苗后发热(38.0°C以上)的平均发生比例为17.1%,39°C及以上的平均发生比例为1.7%,均高于灭活疫苗的对应数据。
mRNA疫苗临床数据特点:No pain,no gain
mRNA疫苗同时具有高保护率和相对更多的不良反应。英美俗语“Nopain, no gain” (“没有痛苦便没有收获”),贴切地形容了mRNA疫苗的特点。
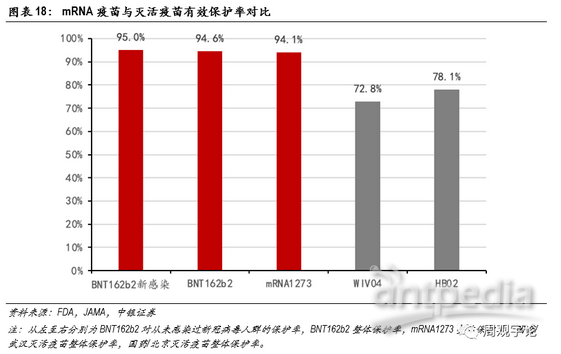
mRNA疫苗对新冠病毒的保护率高达94%以上,国药传统灭活疫苗的保护率虽远远高于WHO和FDA建议标准的50%,但不足80%,与mRNA疫苗差距明显。
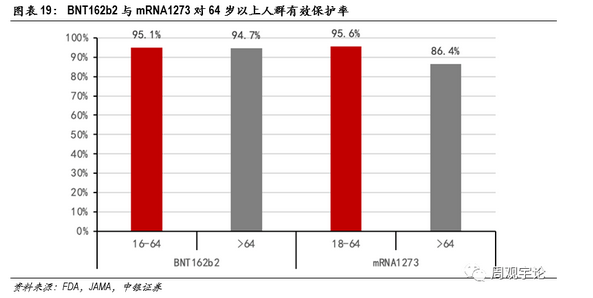
同时,两款mRNA疫苗均对64岁以上的老年人群展现了非常可观的保护率。BioNTech的BNT162b2对64岁以上群体的保护率为94.7%,仅比16-64岁群体数据低0.4%。Moderna的mRNA1273对64岁以上人群的保护率也高达86.4%,仍旧高于灭活疫苗的整体数据。
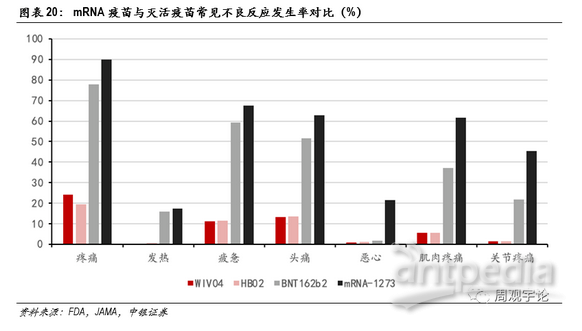
mRNA疫苗严重/致命性不良反应罕见但需关注
mRNA疫苗的各项不良反应发生率都较为明显地高出灭活疫苗对应水平,会让接种者在短期内产生更多的不适感。但在临床试验中并未出现严重甚至致命性的不良反应。
各类新冠疫苗在真实世界中开始运用后,不出意外地,开始出现一些此前在实验阶段未曾出现的不良反应,例如血栓伴血小板减少症候群、心肌炎和心包炎等。
根据美国CDC和FDA数据,截至2021年6月21日,美国共有3款新冠疫苗可供使用,分别为2款mRNA疫苗(辉瑞/BioNTech、Moderna)和1款病毒载体疫苗(强生/杨森)。目前美国共接种3.18亿剂次新冠疫苗,其中病毒载体疫苗(强生)接种剂次超1200万剂次,mRNA疫苗超3亿剂次。
综合3款新冠疫苗的数据,接种后发生过敏的概率为每百万人中2-5人(概率0.0002%-0.0005%)。
美国疫苗不良反应报告系统(VAERS)目前接到有关心肌炎、心包炎的报告616起(发生概率0.0001%),CDC和FDA已确定其中393
2024年3月8日,星锐医药(StarnaTherapeutics),一家聚焦靶向递送技术及创新mRNA疗法的生物技术公司,宣布其自主研发及生产的呼吸道合胞病毒(RSV)mRNA疫苗STR-V003获......
即使在新冠疫情期间接种了数十亿剂疫苗后,信使核糖核酸(mRNA)疫苗仍令人惊讶。近日,《自然》发表的一项研究表明,mRNA疫苗可能会促使细胞产生少量意想不到的蛋白质。研究人员提出一种解决方案,有助于使......
近日,知乎科技和科学领域的“破晓·2023科技回望”活动引来大量关注。活动以前沿突破为触角,发布年度“九大科技事件”榜单,在与人们息息相关的科技应用层,展现2023年科学技术领域的“破晓时刻”。202......
9月15日,中国科学院文献情报中心(简称文献中心)和美国化学文摘社在北京联合发布《全球mRNA疫苗和治疗药物研究分析报告》。《全球mRNA疫苗和治疗药物研究分析报告》封面。文献中心供图《全球mRNA疫......
2019年底突然暴发的新冠疫情让全世界措手不及,疫情的出现也让我们看到并见证了mRNA技术的巨大潜力。但目前只有Moderna和辉瑞/BioNTech开发的两款mRNA疫苗获批上市。稳定性是mRNA疫......
KNAUER自豪地宣布,他们是今年柏林-勃兰登堡创新奖的10名主要提名者之一。KNAUER公司因其碰撞喷射混合(IJM)技术而获得认可,该技术可用于脂质纳米颗粒的高流量生产。目前该技术正用于生产mRN......
前言疫苗是预防传染性疾病传播的最有效的公共卫生干预措施。成功的疫苗接种根除了许多威胁生命的疾病,如天花和脊髓灰质炎,世界卫生组织估计疫苗每年可防止200-300万人死于破伤风、百日咳、流感和麻疹。然而......
随着全球药企陆续披露2021年半年报,营收情况和畅销药种类的排名也相应发生变化。按照药企总营收进行排序,全球营收Top15的药企依次是:强生、罗氏、辉瑞、拜耳、艾伯维、诺华、百时美施贵宝、默沙东、葛兰......
德国KNAUER碰撞喷射混合器(IJM)BioNTech/PfizerCOVID-19疫苗所有生产工厂均采用本套设备。更多详细资料请联系:刘先生15201316651(微信同号)新冠疫情的持续凸显了疫......
NEJM报告2例北京时间4月22日,发表在顶级医学期刊《新英格兰医学杂志》上的一项新研究报告了两例“突破性感染”病例,证实了科学家们对某些新冠变异毒株可以逃避mRNA疫苗的担忧。然而,人们从未指望接种......