报告要点:
全球CRO市场快速增长: 2014 年全球 CRO市场规模达 270亿美元,预计 2017 年达 320亿美元,2020 年达 590亿美元。2014-2020年,CRO全球市场快速增长,年均复合增长率将达 13.91%。
研发投入、创新药、政策驱动,中国CRO市场空间巨大:中国CRO市场于1996年开始发展,起步较晚,且以仿制药临床试验服务为主。2006年,中国 CRO 市场规模仅有 30 亿元,2013年增长至220亿元。随着中国药企研发投入占比提高、创新药研发提速、2015-2016年审评加速、药品注册分类改革以及仿制药一致性评价开展,预计未来3-5年中国CRO市场将至少释放700亿元。
仿制药一致性评价存在“流程复杂、时限短、费用高、资源少”等难点:一致性评价流程复杂,理想状态下完成一个品种评价工作需19个月、花费400-600万元,但可能遇到时间紧张、无法找到参比制剂、BE资源不足等阻力,将使这一政策下的CRO市场缩水。
仿制药一致性评价政策下,预计2018年CRO市场超200亿元,2018年后市场达535亿元:结合考虑仿制药一致性评价的市场大小和竞争、企业决策、参比制剂、BE资源等因素,预计2018年CRO市场将超过200亿元;随着一致性评价开展范围的扩大,预计2018年后CRO市场可达到535亿元。
受益公司推荐:泰格医药,国内CRO龙头企业,临床试验研究经验丰富,持续完善临床前研究、生物样本分析和检测业务,将在一致性评价中发挥其优势。百花村,其子公司华威医药拥有领先的临床前研发水平,十多年来共获得200多个临床批件,同时积极布局“临床前+临床试验+BE/PK生物样品检测+CRC”一站式的药物外包研发服务。
1.全球CRO总体增长,三大企业引领市场
1.1. 全球 CRO 市场增长,快速渗透药企研发业务
1.1.1. CRO 全球市场快速增长,2020 年达 590 亿美元
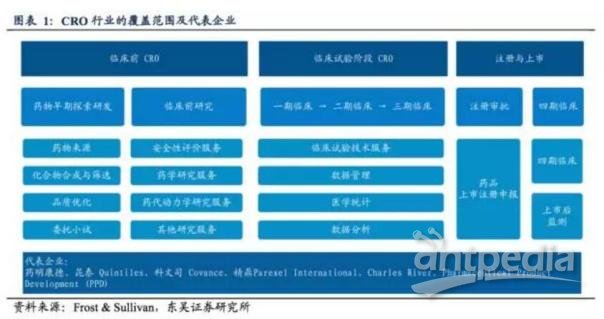
CRO(合同研究组织,Contract Research Organization)通过为制药企业提供贯穿药品临床前、临床试验阶段以及上市审批等环节的药品研发外包服务而创造利润。CRO 服务内容包括化合物合成与筛选、药物安全有效性评价研究、临床试验方案设计、临床试验开展及数据分析管理、药品注册上市审批服务以及上市后监测和四期临床研究等。
全球领先且具有代表性的 CRO 企业有药明康德、昆泰、科文司、精鼎医药等,每个企业的优势领域各有侧重,例如药明康德在临床前外包服务更具有代表性,而昆泰、科文司和精鼎在临床试验阶段更具优势。
2014 年 CRO 全球市场规模达 270 亿美元,预计 2017 年达 320 亿美元,2020 年达 590 亿美元。2014-2020 年,CRO 全球市场快速增长,年均复合增长率可达 13.91%。

1.1.2. 临床试验研究市场份额占比达 67%
2014 年全球 CRO 市场中,临床试验(I-IV 期) CRO占据全球超过半数的市场份额,达 67%,其中三期临床试验占比 35%。超过半数的全球临床试验市场份额得益于不断增加的临床试验研究参与国家数量:从2002年至2012年,参与到每个临床试验研究的国家数量增加3倍,从而使得达到三期临床终点的临床试验研究增长 85%,完成相关方案程序的临床试验研究数量也增加 58%。

1.1.3. 药企外包投入增加,CRO 业务快速渗透
近十年来,新药研发的成功率与投入增长的正相关度越来越小。上个世纪60年代,新药研发投入增加时,批准的新分子实体数量不断增加。2000年以后,即使新药研发投入依然保持高速增长,但新药批准数量却呈下降趋势。

根据 Tufts Center 的调查研究结果,2000-2010 年,一个新药的研发成本为 25.58 亿美元,这个数字在 20 世纪 70 年代仅为 1.79 亿美元。新药研发不仅耗费高额费用,也需要投入巨大的时间成本。一个新药从药物合成研发起至审批上市,至少需要 10 年,其中临床试验阶段耗时最长,需6-7 年,这意味着临床试验一旦延迟,将增加企业的研发成本。根据 Tufts Center 的调查,大多数临床试验都会延迟 1-6 个月完成,导致企业损失 90-540 万美元。


新药研发最终是否能成功是制药行业不可避免的风险。药物 I 期至 II期临床试验的成功率为 59.52%,II 期至 III 期临床试验阶段成功率只有35.53%,从临床试验至上市注册成功率为 61.95%,即使药物已经提交上市申请,也有 10%可能失败。因此,药品从研发至上市成功率仅 11.83%,也就是说,每 10 个进入临床试验阶段的候选药物中,只有 1 个能成功研发获批上市。

为降低药品研发巨大投入伴随的不确定性风险,制药企业越来越倾向于让 CRO 参与到药品研发中。根据 Nice Insight 的调查,2011-2012 年,年研发外包支出在 1000-5000 万美元的企业仅 31%,到 2014-2015 年这一比例增长至 62%。目前,年研发外包支出超过 1000 万美元的药企已达 85%。可见,CRO 在药企研发业务的渗透率越来越高。

1.2. 国际 CRO 市场模式成熟,三大企业引领全球 CRO 市场
全球 CRO 市场发展至今已趋于成熟,CRO 与制药企业之间的合作不再满足于简单的“外包”模式,而是建立长期战略合作,例如昆泰、科文司、精鼎、Icon 和 INC Research 与制药巨头们以功能性服务供应商(FSP,functionalserviceprovider)、虚拟外包等多种模式开展合作,为药企提供更专业和个性化的服务,制药企业可以基于不同的药物开发需求选择不同的CRO公司,借此扩展数据资源,并节约时间和成本。

与制药企业的长期战略合作为 CRO 带来可观的业绩收入。2014 年,全球排名前七位的 CRO 年收入超过 10 亿美元,包括昆泰(Quintiles)、 科文司(Covance)、精鼎(Parexel)、Pharmaceutical Product Development (PPD)、Icon、inVentiv Health 和 PRA Health。全球排名第 8-17 的 9 家 CRO 企业年收入达 1-10 亿美元,例如 Chiltern、CMIC Holdings 等。

2014 年全球 CRO 市场中,昆泰、科文司、PPD、精鼎、ICON 的市场份额位列前五。其中,PPD 在 2011 年以 37.9 亿美元同意私募股权公司凯雷集团(The Carlyle Group) 和 Hellman & Friedman 的现金收购要约,从而退出资本市场。因此上市公司中,排名前三的 CRO 公司分别为昆泰、科文司和精鼎。2013-2015 年,昆泰每年营收都超过 38 亿美元,科文司超过24 亿美元,精鼎营收保持在 17 亿美元以上,并在 2015 年达到 20 亿美元。

1.2.1. 昆泰(Quintiles):领先巨头,打造全方位商业模式
昆泰成立于 1982 年,目前是全球最大的生物制药研发与商业外包服务提供商,业务以临床试验研究为主,贯穿生物分析实验室、基因实验室、临床试验数据管理、生物学统计分析、项目管理以及上市后监测、市场准入等环节,市场覆盖创新药、仿制药、生物制品、生物类似物等。昆泰的员工数量达 36,000 人,全球市场主要分布在北美/拉丁美洲和欧洲,亚洲地区业务仅占其市场份额的20%。2016 年上半年,营业收入为 22.75 亿美元,较 2015 年同期增长 8.1%。2011-2015 年,昆泰营收年均复合增长率达7.0%,净利润年均复合增长率达 21.7%。

2015 年,昆泰 43.26 亿美元的营业收入中,药物研发服务的营收比重达 74%,有 26% 收入来自与医疗服务相关的服务(Integrated Healthcare Services)。
虽然药物研发外包服务仍是昆泰的主要收入来源,但事实上昆泰已形成从传统的临床研发拓展至商业、咨询和资本领域的全方位商业模式,并且正在从初级订单不承担研发风险的传统收费模式,转变为一种与制药公司共同平衡风险/回报的新型合作模式,即昆泰医药与制药企业形成伙伴关系,直接投资参与药品的研发,提供优惠的 CRO 服务,然后分享药品上市后的收益,同时也承担一定的研发失败风险。

2016 年 5 月昆泰与艾美仕(IMS)合并,这意味着艾美仕可将昆泰的患者健康和成本等数据作为大数据支持,为客户提供有更有价值的商业服务;同时昆泰也可以用艾美仕的信息服务方案来优化药物临床研究设计和患者招募等业务,并在商业和咨询领域打造更具价值的真实世界解决方案平台,从而为制药企业提供具有差异化的 CRO 服务。昆泰和艾美仕 2015年营业收入合计达到 72 亿美元,企业市值则将超过 230 亿美元。
1.2.2. 科文司 (Covance):LabCorp 收购+Epic 合作,检测与肿瘤诊断齐驱
科文司 (Covance)总部位于美国新泽西州普林斯顿,是一家市场范围全面、覆盖 30 个国家的全球药物研发服务公司,员工数量有 14000 多,业务范围包括毒理学分析服务、中心实验室服务、药物筛选服务、临床试验管理服务等。科文司于 1998 年进入中国市场,2007 年在上海浦东张江投资设立具有国际水平的中心实验室。
2011-2014 年,科文司的年收入保持在 20 亿美元以上并稳步增长,年均复合增长率 6.3%,净利润保持在 1 亿美元左右。2015 年初,科文司被美国实验室控股公司(LabCorp) 以 61 亿美元收购,收购后 8 个月,科文司为 LabCorp 增加 22 亿美元收入,LabCorp 的 2015 年收入达 85 亿美元。

LabCorp 的核心业务是为制药企业的研发提供中心实验室服务,并有一部分体外诊断业务,是美国独立实验室巨头之一。LabCorp 收购科文司后,使得科文司在中心实验室服务、全面测试分析服务、伴随诊断、临床I-IV 期试验等方面更具优势。
此外,2015 年科文司还与肿瘤诊断公司 Epic Sciences 达成亚洲范围内的合作协议,这将增加科文司在抗肿瘤领域的临床试验研究服务能力。由于科文司在中心实验室服务和肿瘤检测诊断方向的巨大优势进一步增大,预计 2016 年科文司将在临床试验方面增加 2%-5% 的营业收入。

1.2.3. 精鼎(Parexel):跨界合作,寻求更多商业化可能性
精鼎医药(Parexel International)成立于1985年,总部位于美国北卡罗来纳州威尔明顿,提供贯穿药品生命周期的从“药物研发”、“临床试验”至“市场准入”的一站式服务,精鼎医药分支机构遍布全球51个国家的80多个地区,员工数量达18860人。
2013-2015年,精鼎年收入保持在17亿美元以上,并在2015年突破20亿美元,复合增长率为7.8%,净利润从2012年的0.9亿美元增加到2015年的1.48亿美元,复合增长率为24.16%。

临床试验研究服务是2015年精鼎的主要营收来源,占比76%,其次是信息服务和咨询服务,营收分别占比13%和11%。
2016年1月,精鼎与美国医疗保健Optum达成合作伙伴关系,美国医疗保健Optum包含三大业务板块:健康管理服务、覆盖医院,保险公司和政府的医疗行业信息系统、以及药品福利管理服务。基于Optum的真实世界大数据,精鼎能够优化临床试验服务,降低药物研发成本并且改善受试者的护理服务,Optum也能够借此提高患者护理服务水平,从而使整体健康服务更有价值。精鼎和Optum的合作与昆泰和IMS的合作有异曲同工之处,对于CRO公司来说,与商业咨询公司或健康管理服务公司的合作不仅能够获得真实世界的患者数据,为药物研发提供更低成本的实现方式,控制患者医疗费用,更是CRO公司向下游行业延伸寻求更多商业化合作的可能性参考。

国际CRO全球市场的发展历程给我国CRO企业带来如下启示:
1、CRO市场空间和业务渗透率将持续增长,且市场以临床试验研究为主;
2、CRO与制药企业的合作方式应该由“单一订单式”向“功能性服务供应商”等长期合作战略模式转变;
3、CRO企业的发展可向下游行业延伸寻求更多商业化合作的可能性。
2. 中国CRO市场起步虽晚,腾飞在即
昆泰、精鼎等全球CRO企业成立于20世纪80年代,到20世纪90年代欧美CRO市场发展已经较为成熟,21世纪,CRO才开始逐渐往亚洲转移。1996 年,美迪生药业服务公司(MDS Pharma Services)投资设立中国第一家CRO 公司,从事新药的临床研究。随后,跨国 CRO企业陆续在中国设立分支机构:昆泰于1997年进入中国,科文司1998年进入中国,精鼎于2002年在中国成立,PPD于2003年进入中国市场。与此同时,服务于改剂型、仿制药研究等业务的中国本土CRO也逐渐兴起。
目前,中国CRO企业已达300多家,从业务范围来看可以分为三类:
临床前研究CRO,提供化合物合成与筛选、临床前药理毒理试验等服务,代表企业包括药明德康、上海美迪西生物医药有限公司等
临床试验CRO,提供临床试验技术服务、数据分析等服务,大部分跨国CRO企业在中国的分支机构及合资CRO都属于这类,例如昆泰、泰格、北京依格斯医药等
新药研发咨询、药品注册审批代理CRO,主要提供药品申报注册和审批环节的代理服务,目前中国小型CRO机构会单纯从事这类业务,而前两类企业提供的一站式服务里已包含研发咨询及代理注册业务,因此这部分市场占比并不高。

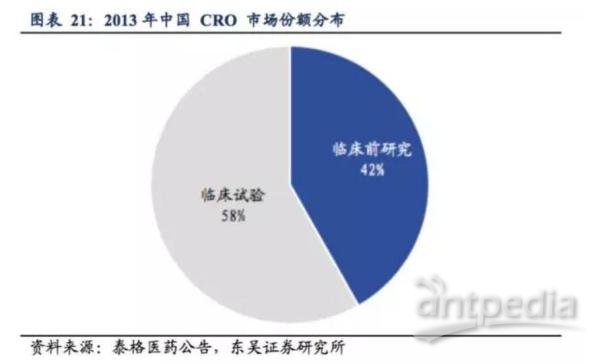
中国 CRO 临床前研究和临床试验服务市场中,临床试验服务市场占比大于前者,2013年临床试验服务占中国 CRO市场份额的58%,临床前研究则占比42%,这与国际CRO市场份额的趋势一致。
中国 CRO 开展的临床试验研究包括“国际多中心临床试验”、“进口注册临床试验”和“国内制药企业注册临床试验”三个部分,其中以仿制药为主的国内药企临床试验最为主流,其次是针对已在国外上市或进行后期研究的药品的进口注册临床试验,开展最少的是国际多中心临床试验。

2006年,中国 CRO 市场规模仅有30亿元,2013年中国CRO市场规模已增长至220亿元,年均复合增长率为32.9%,保持高速增长。临床试验市场年均复合增长33.4%,其市场增长快于临床前研究市场的32.2%。

中国 CRO 市场之所以能快速增长,除中国庞大患者群体、临床试验成本优势以及跨国药企业务在向中国倾斜以外,还得益于国内医药研发投入的持续增长、新药研发数量的井喷以及国家政策的利好,且利好趋势将一直持续。
2.1. 国内医药研发投入持续增长,2014 年达 390 亿元
2006年,中
国药现代(600420)3月7日晚间公告,近日,公司控股子公司国药集团致君(深圳)制药有限公司收到国家药监局核准签发的《药品补充申请批准通知书》,批准注射用头孢哌酮钠舒巴坦钠通过仿制药质量和疗效一致性......
国药现代(600420)3月7日晚间公告,近日,公司控股子公司国药集团致君(深圳)制药有限公司收到国家药监局核准签发的《药品补充申请批准通知书》,批准注射用头孢哌酮钠舒巴坦钠通过仿制药质量和疗效一致性......
2024年全国两会,全国人大代表、华海药业(600521)总裁陈保华带来两项议案与多项建议。针对医药行业,陈保华就药品专利期限补偿制度中增设“出口豁免”规定、新药参比制剂遴选政策、扩大国家集采的慢病药......
2024年以来,上市公司积极发布回购计划,其中,医药生物行业掀起回购潮,累计有110股实施或完成回购计划,已回购金额居前超70亿元。从已回购金额来看,110只医药股中,CRO头部股药明康德已回购金额居......
2022年全球生物仿制药市场规模为251.2亿美元,预计到2032年将达到1260.1亿美元左右,2023年至2032年复合年增长率为17.6%。市场概况生物仿制药市场是生物制药行业的一个部门,专注于......
【全球预临床CRO市场规模在2022年估计为54亿美元,预计到2032年将达到111.8亿美元,预测期间的复合年增长率(CAGR)为7.60%。】主要亮点:生物分析和DMPK研究部分预计将在2023年......
近日,据CDE官网最新公示,正大天晴的1类创新药ATR激酶抑制剂TQB3015片获批临床(默示许可),用于治疗晚期恶性肿瘤。2023年至今,正大天晴药业集团共有4款抗肿瘤(化学或生物药)1类新药冲刺上......
仿制药是与原研药具有相同活性成分、剂型、给药途径和治疗作用的药品。在仿制药的质量和疗效一致性评价过程中,参比制剂的选择是关键环节之一。参比制剂是与原研药进行比较研究的标准物质,用于评估仿制药的质量和疗......
2018年以来,我国已开展8批国家组织药品集采,涉及333种药品。2021年6月起,国家医疗保障局委托首都医科大学宣武医院牵头对第二、三批国家组织集采的23个代表性品种,开展第二期临床疗效和安全性真实......
上周,上海阳光医药采购网官宣了第九批集采将于11月6日正式开标,本轮集采最大的特点就是部分品种集采结果要执行到2027年12月31日,也就是采购周期长达4年,为历次国采标期之最。截至目前,国家组织带量......