12月17日,国家药品监督管理局有条件批准首个国产PD-1单抗——特瑞普利单抗注射液(商品名:拓益)上市。这是我国企业独立研发、具有完全自主知识产权的生物制品创新药品,用于治疗既往标准治疗失败后的局部进展或转移性黑色素瘤。
黑色素瘤在我国近年来呈现快速增长趋势,为发病率增长最快的恶性肿瘤之一,每年新发病例约20000例,在治疗方面,一线治疗失败的黑色素瘤患者客观缓解率不到5%,中位总生存期不到6个月,死亡率也呈逐年快速上升趋势,已经成为严重危及我国人民健康的疾病之一。
国家药品审评中心、药品审核查验中心及中国食品药品检定研究院等相关单位通力协作,主动与申报单位沟通指导,及时解决审评中遇到的技术问题,优先安排技术审评、现场检查和实验室检验,并基于申请人已完成的中国晚期黑色素瘤II期研究有效性数据和7项临床研究的安全性数据,于12月17日有条件批准了本品上市注册,从递交上市申请,到通过优先审评获批,共历时284天。
截至目前,已经有3个PD-1/PD-L1类药物在中国上市,并显示出显著功效。其中,君实生物的特瑞普利单抗与默沙东的Keytruda(帕博利珠单抗)同为黑色素瘤的适应症。国内诸多创新药研发公司也均在这一领域布局。特瑞普利单抗首先获批,也意味着,君实生物成为国内首家PD-1单抗获批的企业。

中国已批准上市的PD-1/PD-L1类药物
值得注意的是,此次君实生物的特瑞普利单抗与默沙东的Keytruda(帕博利珠单抗)的适应证均为黑色素瘤。这也意味着,国产PD-1与进口PD-1已经开始正面交锋。
众所周知,中国已上市了两款PD-1产品,分别是默沙东的K药和BMS的O药。君实生物作为第3家,除了要应对前述两款进口药物的PK,还要对抗后面一波国产PD-1的陆续上市。
君实发展历程
君实生物于2012年12月在上海正式注册成立。其发展模式与一般的生物初创公司“VC+IP+CRO”的发展模式不同,2015年8月13日君实生物在新三板挂牌上市,君实生物先后进行了5次融资,累积13.18亿元。
2018年8月,君实生物向港交所提交上市申请,成为首家“新三板+H股”的公司。
君实生物对自身的定位是通过源头创新来开发首创(First-in-class)或同类最优(Best-in-class)的药物。招股书显示,目前公司的核心管线包括13项在研生物药品。包括七项肿瘤免疫疗法在研药品、两项代谢疾病在研药品、三项针对炎症或自身免疫性疾病药品及一项治疗神经性疾病的药品。

君实研发管线
君实生物拥有苏州、美国旧金山和马里兰三大研发中心,其中苏州/上海(总部)负责研发、工艺优化、产业化生产和临床试验,旧金山研发中心负责新抗体研发、高通量抗体筛选,马里兰研发中心负责抗体评估、新靶点开发。另外,君实生物在苏州吴江和上海临港设立两个生产基地。
2016和2017年,君实生物的研发投入分别为1.22亿元和2.75亿元,截至2018年4月底,研发投入达到了1.22亿,同比增加96.77%。
从创始团队来看,君实生物总经理李宁曾在美国FDA担任肿瘤产品团队审评员等职务,后在赛诺菲任全球监管事务亚洲监管事务及医学政策副总裁;首席运营官冯辉曾任阿斯利康附属公司MedImmune的科学家,并参与了JS001的专利发明;首席科学官武海曾任安进高级科学家;临床研究运营部副总经理顾娟红曾先后就职于第一三共、默沙东、GSK医疗及药物开发部临床运作主管。
可以看到的是,相比于拥有强悍销售能力的恒瑞、由吴晓滨操作商业化的百济神州,目前君实生物并没有来自市场、销售方面的领头人,也没有重金在销售方面进行布局,君实生物的商业化能力目前有待验证。
在合作伙伴上面,君实生物2018年7月11日与石药集团签订《产品合作开发与战略合作协议》。根据协议,JS001将与石药集团的注射用紫杉醇组合开展针对乳腺癌的临床开发。而该协议的签署也许将有助于君实与石药集团开展商业化方面的合作。
国产第一家
实际上,君实生物能成为国产PD-1第一家并不奇怪。特瑞普利单抗是国内第一家向国家药监局提交临床试验申请的PD-1抑制剂产品。
Insight数据库显示,特瑞普利单抗目前有18项临床试验正在开展,其中针对复发或转移性鼻咽癌的三期临床试验为国际多中心试验,此外还有针对黑色素瘤的三期试验在进行,2018年10月18日已经完成第一例受试者入组。四个试验处于二期临床,适应症包括非小细胞肺癌、鼻咽癌、膀胱癌、黑色素瘤;10个临床试验处一期临床阶段。

君实生物的临床试验数据披露也比较全面。从已有数据来看,JS001与百济神州、信达的PD-1单抗都安全性可靠,有效性非劣于O药和K药。
特瑞普利单抗到底是什么样的药物?
拥有完全自主知识产权
➢ 新型重组人源化( 97%) PD-1抑制剂,属于人IgG4/Kappa亚型。
➢ 全新的CDR序列,独特FG环结合位点。
➢ 完全具有自主知识产权,已获中国专利授权(授权号为CN104250302B) , PCT专利公开号WO2014/206107A1。

具有双重作用机制,强力抑制肿瘤
机制一:阻断PD-1/PD-L1信号通路,提高体内外T细胞增殖及抗肿瘤效应;
机制二:通过内吞效应降低PD-1膜表面表达,恢复T细胞自身活化功能;
并具有以下优势:
1.高亲和力结合PD-1,强效阻断PD-1通路,提高疗效;
2.介导内吞,降低PD-1膜表面表达;
3.显著提高体内外T细胞增殖能力及抗肿瘤效应;

卓越的体内抗肿瘤生长效果

人体临床研究显示,长期生存受益患者PD-1受体下调显著(平均是治疗前的30%),而疾病进展患者存在PD-1表达上调现象,这些结果表明PD-1膜表面表达下调和疗效正相关,也进一步支持了特瑞普利单抗的抗肿瘤作用。
卓越的疗效和良好的耐受性

特瑞普利单抗临床研究结果
特瑞普利单抗全面布局中国黑色瘤人群,更多研究也在进行中,让我们期待临床结果早日揭晓。
CT8 -II 期试验-辅助治疗:一项考察重组人源化抗PD-1 单克隆抗体注射液对比大剂量干扰素辅助治疗完全切除的黏膜黑色瘤随机、 对照多中心Ⅱ期临床研究研究目的是比较对比干扰素完全切除的粘膜型黑色瘤患者无复发生存期。
CT17 -III 期试验-一线治疗:一项考察重组人源化抗 PD-1 单克隆抗体注射液(拓益)对比达卡巴嗪一线治疗不可切除的或转移性黑色素瘤随机、对照多中心Ⅲ期临床研究。
据悉,除了恶性黑色素瘤这个适应症,君实生物还正与中国众多临床试验中心的KOL及PI合作,进行包含尿路上皮癌、胃癌、食管癌及鼻咽癌等肿瘤适应症2期和3期临床试验,有望在未来几年获批更多适应症,为更多肿瘤患者带来生命希望。
结论,特瑞普利单抗是:
o国内首个获批上市的国产原研PD-1抑制剂
o拥有完全自主知识产权
o双作用机制,强力抗肿瘤
o在治疗晚期粘膜黑色素瘤上显示出卓越的疗效,联合治疗更是世界突破
总之,不管是单药还是联合治疗,拓益已经在中国恶性黑色素瘤患者中显示出了优异的临床数据,有望成为国人黑色素瘤的标准治疗方案。
这是一个竞争极其激烈的市场,这一方面对于中国创新药是一个里程碑式的事件,代表了中国创新药的能力上了一个新台阶。另一方面,多个同类产品同时涌入市场,那么先行者抢占市场的优势并不明显,未来的厮杀将依靠企业的综合实力,比如销售能力、临床试验布局、现金流、对终端的把控能力等等。
特瑞普利单抗与国内其他家临床数据比较
国产PD-1陆续获批上市后,是否会打价格战?这些问题目前下结论为时尚早。我们不妨先看一下信达、恒瑞、百济神州在首个申报上市适应症cHL上的临床数据。

3款国产PD-1的cHL临床数据
信达在今年5月召开的ASCO大会期间公布了信迪利单抗一项治疗r/r cHL的II期数据(ORIENT-1研究)。结果显示:独立中心影像评估委员会(IRRC)对96例患者的24周临床数据评估后发现,ORR为79.2%,DCR为97.9%。
恒瑞在今年9月召开的CSCO学术年会上公布了卡瑞利珠单抗在中国r/r cHL患者开展的一项II期研究的结果。根据IRC评价的有效性分析:共56例患者达到客观缓解,ORR为84.8%,其中CR 30.3%(20例),PR 54.4%(36例)。另外有8例患者实现疾病稳定,SD率为12.1%。研究期间可观察到患者靶病灶肿瘤负荷明显减少。
百济神州在最近召开的ASH2018年会上公布了替雷利珠单抗治疗r/r cHL中国患者的关键性II期临床研究的数据。该试验共入组70位先前接受ASCT治疗失败、病情进展或先前接受至少两项系统治疗且不适合ASCT的患者。基于IRC评估的ORR为85.7%(60/70);其中CR 61.4%(43/70),PR 24.4%(17/70)。先前接受过ASCT治疗的患者中,92.3%(12/13)都达到了客观缓解,其中有9位病人(69.2%)达到了CR。
从以上疗效数据来看,似乎很难一下子断出高低。实际上关于同类产品的比较,以国外上市多年的O药与K药来说,至今仍然是说法不一。
如何赢得市场?
相信国产PD-1的价格制定会更加理性,而接下来,医保部门的态度又会如何?PD-1是否会通过动态调整的方式参加医保价格谈判?据了解,11月,深圳人社局发布了《2018年<深圳市重特大疾病补充医疗保险药品目录>增补遴选专家评审结果公示》,K药(Keytruda)赫然在列。
医药魔方记者就特瑞普利单抗的定价、销售等问题采访了君实生物的首席运营官冯辉博士。冯辉回复称:“特瑞普利单抗的价格目前尚未确定,公司正在内部研究,但是相比进口药肯定是会一个有竞争力的价格”。另外,当被问到外部有人认为君实的销售能力有待检验时,冯辉透露称:“君实目前已经自建了一支销售团队,并计划招募200多人。团队负责人和主要成员都来自于跨国药企,有丰富的肿瘤药物销售经验。公司将会根据特瑞普利的特点和临床试验数据制定创新的营销医疗策略。”
同时还表示,“自建销售团队是第一步,与O药和K药在国内的渠道合作类似,销售渠道的布局君实是一定会做的,我们会以国控、上药及华润三大运营商为主,以当地优质运营商为辅,铺设几百家医院及DTP药房。君实目前保留着特瑞普利的境内外自主权益,我们可以和各种合作伙伴考虑有建设性的合作模式。随着与各个研发合作伙伴在各种临床开发上的推进,未来也可以逐步考虑在销售上建立合作”。
在问及特瑞普利单抗相比Keytruda的市场竞争优势时,冯辉表示价格只是一方面;在疗效方面,特瑞普利单抗在ORR、DCR、DOR、PFS等指标上都有不弱于甚至优于K药的数据,这一点在特瑞普利单抗的药明说明书中将会体现。

君实JS001各适应症疗效数据
不管如何,我们在今天迎来了国产PD-1上市的时代,后面也将有更多国产PD-1上市供国内患者选择。充分的市场竞争也将给更多患者带来可以切合自身需求的用药选择。
国内价格战?
据了解,首个国产PD-1的价格尚未确定,不过君实的定价策略确实需要更多的考量。君实生物在招股书中展示了全球和中国PD-1/L1市场规模。全球PD-1及PD-L1抑制剂销售额从2015年的16亿美金上升到了2017年时的101亿美金,复合增速达到了154.2%,预计2017年至2022年复合年增长率为29.3%,市场规模预计在2030年达到789亿美元。但从2017年开始,增长率将会迅速减缓,预计2017年至2022年,复合增长率为29.3%,2022~2030年的复合增长率为10.1%。

国内PD-1及PD-L1抑制剂市场仍处于发展初期。销售模式上,O药和K药均选择了与本土商业公司合作,将总代理权签给了上海医药。据上海医药第3季度财报数据,截止报告期末,上海医药在O药和K药上的分销收入分别达到1.9亿元和1.5亿元,这也提示O药和K药在国内上市几个月时间就取得了可喜的销售业绩。PD-1/L1抑制剂的市场规模预计将于2018年至2022年期间以534.4%的复合年增长率增长至2022年的374亿人民币。但2022~2030年的复合增长率将缩减至12.8%。

面对广阔的市场前景,企业都在积极布局。目前,全球仅有3个PD-1(Libtayo®-赛诺菲和再生元,Keytruda®-默沙东,Opdivo® -BMS)靶点药物和3个PD-L1(Imfinzi®-阿斯利康,Bavencio®-默克/辉瑞,Tecentriq®-罗氏)靶点药物上市。
在国内,除了此前已获批的Opdivo(BMS)和Keytruda(默沙东),信达、恒瑞和百济的PD-1/PD-L1也在申报上市的路上。此外,据不完全统计,国内共有20余家企业参与PD-1/PD-L1领域的竞争,处于临床不同阶段。

国内当前PD-1和PD-L1进展(截止到2018年12月)。

国内PD-1药物研发汇总

国内PD-L1药物研发汇总
在激烈的品种竞争下,除了疗效,价格也是抢占市场的重要因素。尤其在国家医保谈判以及带量采购背景下,进口药均面临不小的降价压力。根据官方公布的价格,O药的价格为40mg/10ml 4591元、100mg/10ml 9260元,60kg的患者一个月需要36884元,而在美国则需要66056元。K药的中国零售价为17918元/100mg,全年治疗费用为304606元,仅为美国市场价格的54%。两款进口PD-1都选择了牺牲单价换取潜在销量的定价策略。
分析人士指出,O药与K药均以全球最低价格在我国上市,可见两家公司对中国市场的期望,也可以推断未来PD-1市场竞争的激烈。一方面,国产PD-1研发的推进迫使跨国药企调低价格;反过来,进口PD-1的低价策略,也对国产PD-1的价格形成阻击,价格天花板已经摆在那里。
,临床试验患者紧缺
自2006年,首个PD-1单抗nivolumab开展临床试验以来,到目前为止,FDA已经批准了一共六款PD1/PDL1抗体药物,PD1/PDL1抗体药物已经成为肿瘤免疫领域的重要组成部分。
与此同时,PD1/PDL1抗体药物临床试验的数量显著增长,已经从2006年的区区一项,增长至2018年目前的2250项!
11月28日,由纽约癌症研究所(CRI)唐钧博士领衔的《PD1/PDL1免疫检查点抑制剂临床试验现状》调查报告重磅公布!内容发表在著名期刊Nature Reviews Drug Discovery(影响因子50.167)上。

纽约癌症研究所是一家非盈利的学术组织,致力于癌症免疫治疗领域方面的研究已经超过65年。在这项报告中,唐博士主要分析了当前PD1/PDL1抗体药物相关临床试验的现状,并与2017年9月另外一项调查报告的结果进行比较。
临床试验蓬勃发展背后,低效研究设计泛滥,患者缺口巨大
调查报告指出,在这一年的时间里(2017年9月至2018年9月),又有748项临床试验最新开展,活跃状态的临床试验共计有2250项。在这2250项临床试验中,1716项临床试验的治疗方案为PD1/PDL1抗体药物与其他癌症疗法相联合。

PD1/PDL1免疫检查点抑制剂临床试验现状
虽然,目前仅有两项PD1联合疗法获得FDA批准(nivolumab+ipilimumab和pembrolizumab+化疗),但是,其他针对240种不同靶点的PD1/PDL1抗体药物联合疗法,临床试验评估也正在火热进行。
此外,与去年相比,今年联合疗法相关临床试验所针对的靶点又多了75个。
在这当前的1716项联合治疗临床试验中,有339项所使用的免疫治疗药物为CTLA4抗体,使得CTLA4成为PD1/PDL1抗体药物联合治疗中最常应用的靶点。其他常见的联合疗法包括化疗(283项临床试验)、放疗(114项临床试验)、放化疗(58项临床试验)以及抗血管生成剂(52项VEGFA相关临床试验)。
值得注意的是,在过去一年所有新开展的联合试验中,IDO1和PARP抑制剂相关联合试验分别有25项和23项。

2017年9月至今PD1/PDL1疗法联合试验的靶点
从治疗的癌症类型看,在PD1/PDL1抗体药物单药治疗或联合治疗临床试验中,研究前五位的癌症分别是肺癌(254项临床试验)、黑色素瘤(139项临床试验)、乳腺癌(106项临床试验)、淋巴瘤(99项临床试验)和头颈部癌(72项临床试验)。
值得注意的是,与黑色素瘤相关的新开展的临床试验近期增长缓慢,这很可能与nivolumab和ipilimumab的联合用药获批有关。这两种药物联合使用的治疗效果非凡,缓解率(RR)更是达到了58%,可能为其他新型临床试验的展开设置了太高的目标。

PD1/PDL1疗法临床试验数量的巨大飞跃(2006-2017年)
总的来说,这些临床试验将招募总共380900例患者。而在过去的5年中,临床试验对于患者志愿者的需求量大大增加。举个例子,仅2017年新开展的临床试验就需要招募105489例患者。

PD1/PDL1疗法临床试验患者志愿者需求猛增
基于这种对患者志愿者的巨大需求,这项调查报告对533例PD1/PDL1相关临床试验和2781例不涉及PD1/PDL1的肿瘤学临床试验的患者招募数据进行了分析。唐博士等人惊讶的发现,在过去的四年中,与其他肿瘤学临床试验相比,PD1/PDL1相关临床试验招募患者的速度更快。

不同类型癌症PD1/PDL1疗法临床试验的招募
然而,这种招募速度在近期发生了显著的下降,在2014年的时候每处中心平均每月还能招募1.15例患者,而到了2018年,每处中心平均每月只能招募0.35个患者。这表明,对于一些特定类型的癌症而言,PD1/PDL1相关联合试验的患者招募可能在明年面临难题。

PD1/PDL1抗体疗法临床试验患者招募效率
小结:
与2017年的临床试验状况相比,今年临床试验的规模明显扩大。不仅临床试验的数量新增了748项,而且治疗靶点新增75种。伴随而来的是,临床试验对于患者志愿者的需求也更大,目前的需求已经超过100000例。在过去的一年中,FDA批准了另外13种PD1/PDL1抗体药物,其中有一种为新型PD1单抗(cemiplimab)。目前相关临床试验的开展极其活跃,这表明未来或许会有更多更有效的抗癌药物。
然而,这些临床试验中同样有一些治疗方案充斥着重复、低效以及过时的研究设计。不仅如此,患者招募效率的显着下降也带来了不好的信号。由于目前临床试验面对的患者志愿者数量有限,因此,研究人员有必要将资源和精力优先分配在最具创新性和潜力的PD1/PDL1单抗治疗方案上。
《全球肿瘤免疫治疗发展趋势》
此前(10月19日),唐钧博士的另外一项《全球肿瘤免疫治疗发展趋势》调查报告也发表在了Nature Reviews Drug Discovery上。鉴于免疫疗法的飞速发展,唐博士等人曾在去年(2017年9月)开展了一项全球肿瘤免疫治疗现状的综合调查,而在今年(2018年9月)又开展了另外一项现状调查。

这篇报告,对两项调查的结果进行了全面比较和纵向分析,并就免疫疗法的发展趋势做了详尽分析。
趋势一:免疫疗法管线激增67%
根据不同的作用机制,可以将免疫治疗药物分为六大类:
① 靶向T细胞的免疫调节药物(如PD1/CTLA4单抗)
② 其他免疫调节药物(如TLR/IFNAR1激动剂)
③ 癌症疫苗(如BCG疫苗)
④ 细胞疗法(如CAR-T/TCR-T疗法)
⑤ 溶瘤病毒(如T-vec)
⑥ 靶向CD3的双特异性抗体(如blinatumomab)
报告指出,在过去的一年中(2017/9-2018/9月),全球肿瘤免疫治疗市场,药物研发项目激增67%(2031→3394)!
在这六个不同类别的免疫疗法中,细胞疗法增幅最大,达到113%;而溶瘤病毒增长甚微,仅为16%。

免疫疗法项目趋势
截至2018年9月,细胞疗法已经赶超癌症疫苗,成为癌症免疫疗法第一大类,项目总数多达864种,占所有免疫疗法的25%!
趋势二:免疫治疗靶点增长50%!
在过去的一年中,肿瘤免疫疗法的靶点增长了约50%,当前全球在研项目共有417个靶点。有趣的是,去年有一半的项目集中在23种热门靶点,而今年一半的药物项目则分布于前48种热门靶点。
未攻克的靶点(尚未有获批新药),研发项目更多。举例来说,过去一年中细胞疗法项目增长幅度有113%,但CD19靶向的细胞疗法仅增加37%。相反,在一年的时间里,靶向肿瘤新抗原的研发项目则增加了133%。

免疫疗法15大热门靶点
增长的靶点数量可能为未来肿瘤免疫治疗带来更多的药物。值得注意的是,针对非特异性肿瘤相关抗原(TAA)的药物项目正在减少,这表明免疫治疗领域正在向着更加精准的方向发展!
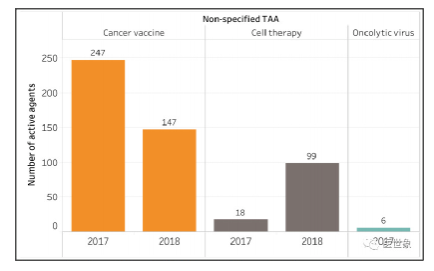
非特异性TAA药物项目减少
趋势三:研发企业机构增加42%
在2017年9月,共有461家企业与机构积极研发免疫疗法。而在一年后的现在,参与的公司与机构已经增长到了655家,足足增长了42%!
研发项目排名前15的机构中,大型制药公司仍旧占据着主导地位,因为前8位均为大型制药公司。有4家为科研机构,其中3家来自中国,分别为深圳市免疫基因治疗研究院、301医院和第三军医大学第一附属医院。

免疫疗法排名前15家企业与机构
此外,这些机构临床前阶段研究的增长(1,067→2,107;增加97%),要超过临床阶段增长(964→1,287;增加34%),这表明临床前研究的创新层出不穷!
小结
免疫疗法正在快速的进入美国、欧洲和日本以外的主要市场。中国已于近期批准了nivolumab和pembrolizumab这两款免疫治疗药物用于癌症的治疗。大量临床研究证明,免疫疗法能为患者带来持续益处,为一些类型的癌症带来治愈的希望。虽然癌症的免疫治疗获得了许多成功,但是近期IDO1抑制剂Ⅲ期临床研究的失利也同样提醒我们,免疫疗法的开拓并非一帆风顺。
《癌症细胞疗法全球图谱》
文章到这里还没有结束,此前,唐钧博士还发表了《癌症细胞疗法全球图谱》调查报告,也同样是发表在Nature Reviews Drug Discovery上,在这篇报告中唐博士分析了免疫疗法中癌症细胞疗法的全球发展态势。
我们知道,通常根据不同的作用机制,可以把细胞疗法分为7类,包括CAR-T疗法、TCR-T疗法、TAA/TSA(肿瘤相关抗原/肿瘤特异抗原)靶向的自体循环T细胞疗法、TIL疗法、基于新技术(如iPSCs、CRISPR或γδT细胞)的T细胞疗法、NK/NKT细胞疗法、以及其他类型的细胞(如巨噬细胞或干细胞)疗法。
那癌症细胞疗法的全球发展态势又是什么样的呢?
进展与分布
唐教授在这片报告中指出,目前,全球共有753项癌症细胞疗法,其中378项处于临床前阶段;375项已经进入临床试验阶段。在这375项进入临床试验的细胞疗法中,160项处于Ⅰ期临床试验,205项处于Ⅱ期临床试验,6项已经进入了Ⅲ期临床试验,还有4项细胞疗法已经获批(美国2项、韩国1项、意大利1项)。

进入临床后期、已经获批的细胞疗法
值得强调的是,753项细胞疗法中,有404项都是CAR-T细胞疗法!

不同类型细胞疗法的数量
从地理位置的角度分析,细胞疗法的三大创新集群分别为北美(主要是美国)、东亚(包括澳大利亚和新加坡)以及西欧(包括以色列),分别占据了357项、268项以及128项细胞疗法研发项目。
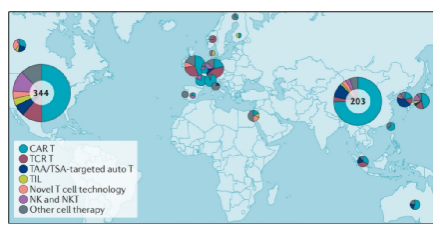
753项细胞疗法的全球分布情况
从国家的角度分析,美国和中国在国际细胞疗法的研发中占据主导地位,分别拥有344项和203项细胞疗法项目,占据全球总量的73%!
也就是说,中国细胞疗法的研发地位,仅排在美国之后,位居全球第二!
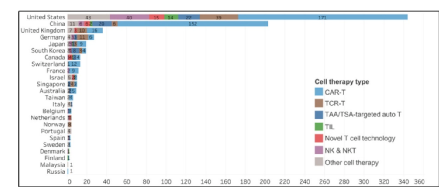
细胞疗法数量国家排行
靶点和趋势
目前,细胞治疗领域共有113种不同的靶点,其中73种正在进行临床试验。当前研究最为热门的2类靶点为CD19和TAA/TSA,分别是CAR-T疗法和其他类型细胞疗法的主要靶点。
前30种热门靶点及其临床阶段如下图所示。

癌症细胞疗法TOP30治疗靶点
尽管靶向CD19或B细胞成熟抗原(BCMA)的CAR-T细胞疗法,目前已经取得了前所未有的临床治疗效果,但是目前仍面临诸多的挑战,比如部分血液系统恶性肿瘤的患者体内CAR-T细胞续存时间依然较短;免疫抑制微环境作用下,实体瘤渗透不良,肿瘤杀灭效果差等等,这些问题都亟待解决!
相信随着细胞工程学和生物学的持续发展,以及制造水平的不断提高,未来这些问题都将得到有效解决。但是目前,已经有许多研究人员将目光转向,将细胞疗法与免疫检查点抑制剂结合起来,来克服细胞疗法的这些缺陷。
通过检索ClinicalTrials.gov,我们可以发现目前有20项正在开展的临床试验,都集中在联合细胞疗法和靶向PD1/PDL1制剂来治疗大部分类型的肿瘤。其中有16项联合研究中所使用的免疫疗法药物均为pembrolizumab和nivolumab这两种获批的抗PD1药物。

细胞疗法联合抗PD1/L1制剂当前临床试验
此外,与其他治疗领域企业研发所发挥的重要作用相比,学术科研机构在细胞疗法的开拓中起到了至关重要的作用!根据纽约癌症研究所(CRI)的数据库显示,中国的203项细胞治疗中,有125项(62%)由学术科研机构拥有和开发,而美国仅为23.0%!
在这125项疗法中,有116项(93%)已处于临床研究阶段。不仅如此,中国细胞疗法的研究更钟情于CAR-T细胞疗法!但是,其中绝大多数CAR-T疗法并非创新型疗法,其性能与美国已经批准的,或处于临床开发后期的疗法相似。
挑战和机遇
尽管近期已有多项细胞疗法获批,临床治疗也显示出可观的疗效,但是细胞疗法面临的挑战依然存在!
唐博士针对目前面临的病毒载体生产局限、临床试验规模受限、实体瘤治疗效果有限等3个主要问题,建议采用以下不同的解决方法:针对病毒载体生产问题,可以通过开发非病毒载体技术,并进行临床评估;针对临床试验受试者规模问题,建议采用新的临床设计,在单个临床研究中评估多种细胞疗法和靶点;针对实体瘤治疗效果问题,建议开发新的细胞疗法,并集中于对现有疗法无反应,或易产生耐药性的实体瘤类型。
参考资料
1. The clinical trial landscape for PD1/PDL1 immune checkpoint inhibitors
https://doi.org/10.1038/nrd.2018.210
2. Trends in the global immuno-oncology landscape
https://doi.org/10.1038/nrd.2018.202
3. The global landscape of cancer cell therapy
DOI:https://doi.org/10.1038/nrd.2018.74
或将有望通过医保加速进院速度,从而上量。2022年医保目录调整工作正在有序进行,根据国家医保局印发的2022年国家医保目录调整工作方案,2017年1月1日至2022年6月30日期间,经国家药监部门批准......
对调节肿瘤微环境(TME)的肿瘤细胞衍生的小细胞外囊泡(sEV)的研究为头颈部鳞状细胞癌(HNSCC)的靶向治疗提供了策略。2022年5月6日,上海交通大学严明及陈万涛共同通讯在JournalofEx......
近日,郑州大学药学院教授刘宏民、郑一超等发现,组蛋白去甲基化酶LSD1可以调节胃癌患者体内T细胞肿瘤免疫,为针对胃癌的靶向免疫治疗提供了新靶点。该研究于3月16日在线发表于《分子癌症》(Molecul......
免疫疗法在临床上已经成功应用于治疗多种血液学和实体转移性恶性肿瘤。最广泛使用的靶向免疫检查点的药物,如程序性细胞死亡蛋白1(PD-1)及其配体PD-L1,对一部分癌症患者有效。然而,抗PD-1/PD-......
PD-1抗体已被应用于多种肿瘤的临床治疗,但其存在的初始抗性和获得性抗性两个问题极大限制了PD-1的临床应用。近日,美国维克森林大学医学院的研究团队在《NatureBiomedicalEngineer......
近日,帕妥珠单抗和曲妥珠单抗的III期临床评价(CLEOPATRA)试验建立了帕妥珠单抗、曲妥珠单抗和多西他赛联合治疗方案作为人表皮生长因子受体2(HER2)阳性局部复发/转移乳腺癌(LR/mBC)的......
根据世界卫生组织国际癌症研究机构(IARC)发布的2020年全球癌症负担数据,肝癌是全球癌症死亡的第三大原因。肝细胞癌是原发性肝癌的主要类型,中国肝细胞癌发病率高,几乎占全球一半的病例,乙型肝炎病毒(......
随着新冠疫苗接种行动在全球开展,一些国家和地区的新冠疫情逐渐的得到控制。当然,关于疫苗副作用的问题始终是人们关注的焦点。最近,Nature子刊NatureMedicine揭示了一则由辉瑞/BioNTe......
肿瘤细胞通过诱导免疫检查点的异常表达逃避免疫细胞攻击。靶向T细胞免疫检查点PD1/PDL1的免疫疗法可恢复CD8+T细胞功能,成为当前最受期待的有可能治愈恶性肿瘤的方法,但大部分患者因为原发或继发耐药......
5月18日,NatureCommunications在线发表了中国科学院上海巴斯德研究所研究员黄忠课题组和中科院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)研究员丛尧课题组、广州市妇女儿童医......