转座子被认为是宿主基因组演化的重要推动力。其类型众多,包含non-LTR(Long Terminal Repeat)型逆转座子、LTR型逆转座子、Helitron型DNA转座子、TIR(Terminal Inverted Repeat)型DNA转座子等,可引起包含基因重复(gene duplication)在内的各种遗传突变。已有研究表明,non-LTR型逆转座子在人类基因组中介导基因重复,产生大量新基因。2016年,中国科学院院动物研究所研究员张勇研究组研究发现,动物中LTR可借由模板跳转介导基因重复;Helitron在蝙蝠中通过通读(transduction)的形式介导基因重复。迄今,TIR型转座子介导基因重复的能力只在植物中被揭示,其中水稻中的MULE元件捕获大量宿主基因,形成Pack-MULE的嵌合结构。但TIR型转座子介导基因重复形成的机制仍不清楚,动物中此类基因重复也鲜有报道。
7月13日,张勇研究组等在Nature Communications上,在线发表了题为DNA transposons mediate duplications via transposition-independent and -dependent mechanisms in metazoans的研究论文。该研究首次大规模搜索了100个动物基因组,鉴定了TIR转座子介导的基因重复,并将其命名为Pack-TIR。研究发现,大部分基因重复的产生不依赖转座活性,符合缺口填补(gap-filling)模型;在黑腹果蝇群体基因组数据中找到的最年轻的多拷贝基因Ssk-FB4则符合新提出的模板跳转及转座(FoSTeST)模型。蛋白质组、自然选择压力分析及表型关联分析显示Ssk-FB4s编码功能蛋白。上述结果证明TIR转座子可以重塑基因结构,产生新基因。
研究中,科研人员收集了公共数据库UCSC中100个后生动物的基因组,计算分析鉴定出370个Pack-TIR元件(图1A)。进而,同时在黑腹果蝇群体中鉴定出一个多拷贝Pack-TIR家族:Ssk-FB4(由FB4 转座子捕获基因Ssk所形成的新基因)。其基因结构和植物中Pack-MULE相似,中间为捕获的外源序列,两侧为TIR转座子序列(图1B)。
研究发现,Pack-TIR与TIR转座子数目成线性正相关(图2A)。对灵长类谱系中Pack-TIR的起源时间分析发现,其零散分布在各演化枝上(图2B)。这些Pack-TIR在各个时间段皆有起源,即使宿主编码的转座子已丧失转座活性。由此推断,大部分Pack-TIR的产生不依赖于转座活性(transposition-independent)。多方面证据表明,Pack-TIR的形成符合缺口填补(gap-filling)模型(图2C):Pack-TIR的丰度与其到母源序列的距离呈负相关,即TIR转座子倾向于捕获临近序列;67.6%事件含有微同源序列(Pack-TIR与母源序列共享较短的相似序列);灵长类物种间的比较分析显示,转座子和外源序列是先后插入的两次独立事件。随后,研究人员发现果蝇中Ssk-FB4其形成过程与缺口填补模型不符,因此提出复制叉停滞-模板跳转-转座(FoSTeST)这一新模型来解释多拷贝Pack-TIR的产生(图2D)。该模型与缺口填补模型不同,模板跳转后转座酶会立即将嵌合的Pack-TIR转座到基因组其它位置,科研人员的策略及发现对植物中Pack-MULE的起源机制研究将具有启发意义。
除机制方面的分析,科研人员还结合转录组数据和进化基因组数据探索Pack-TIRs的功能。研究发现,Pack-TIR倾向于捕获外显子序列,且大部分与所在基因发生融合,具有转录信号(图3A)。Ssk-FB4是罕见的编码功能蛋白的例子,所有拷贝不仅显示出较高的转录和翻译水平(图3B-C),且各拷贝的非同义突变在细胞膜外结构域显著富集,暗示其受到正选择(图3D)。此外,突变机制所赋予的Ssk-FB4嵌合结构使其更容易发挥新功能,可能增加果蝇抵御环境中致病微生物的能力(图3E-F);转座带来的拷贝数增加使自然选择有更多的作用对象,推动了适应性进化更快发生。
该研究由中国科学院动物研究所、法国居里研究所、北京大学肿瘤医院等机构合作完成。研究工作得到国家重点研发计划、国家自然科学基金、中科院青年创新促进会等资助。
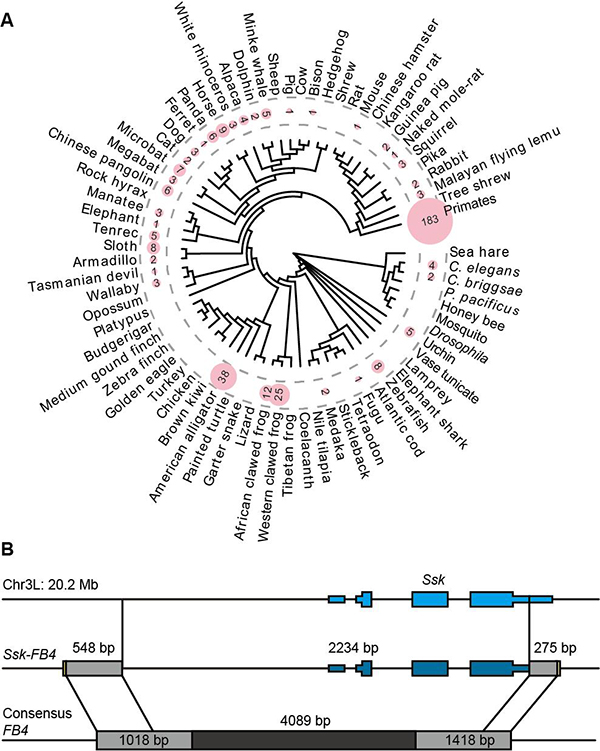
图1.动物中Pack-TIR分布及结构示意图。(A)370个Pack-TIR在100个动物中分布情况。圆圈内数字表示对应物种的Pack-TIR数目。(B)黑腹果蝇群体中Ssk-FB4的基因结构。蓝色片段为Ssk的外显子,黑色和灰片段为FB4序列。
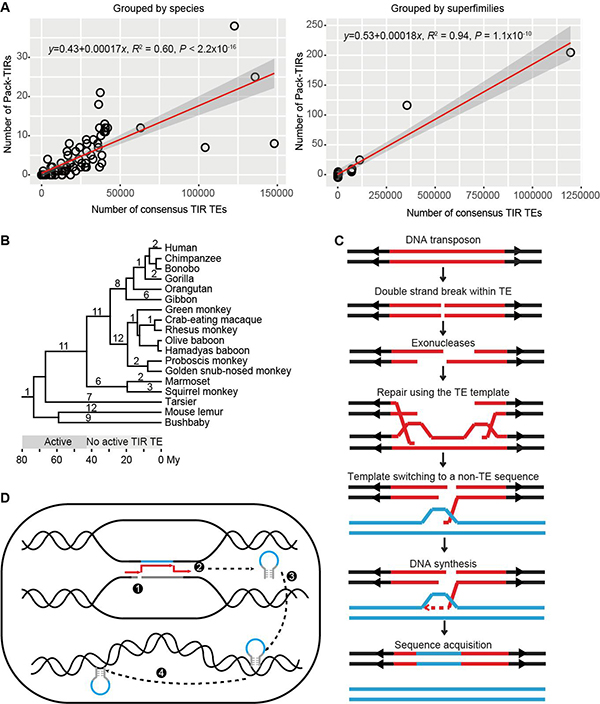
图2.动物中Pack-TIR形成的两种机制。(A)各物种或各转座子超家族中Pack-TIR与TIR转座子数目的线性关系。(B)Pack-TIR在灵长类动物演化树上的分布,数字表示Pack-TIR出现在某一特定演化枝的个数,下方显示了转座子活跃与否的时间,单位为百万年。(C)缺口填补模型示意图。红色片段及两侧箭头表示为DNA转座子,蓝色片段为外源序列。该图显示转座子内部双链断裂,也可能是转座子的自主切割引发缺口。(D)FoSTeST模型示意图。1.复制叉停滞在转座子处并发生双链断裂;2.转座子和母源序列空间接近,导致修复时模板跳转产生嵌合片段;3.转座酶识别嵌合片段,切割插入到其它位置;4.由于Ssk-FB4保留转座子的末端反向重复序列(TIR),在转座酶的帮助下增加其拷贝数。
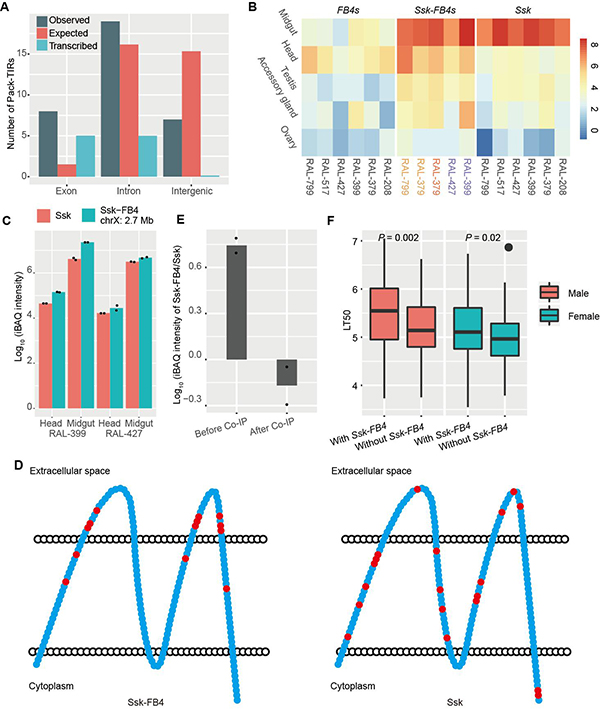
图3.Pack-TIRs的表达、选择和关联分析。(A)人类中Pack-TIR捕获序列的类型分布情况。(B)Ssk、Ssk-FB4、FB4在六个黑腹果蝇品系五个组织内的表达谱,表达值为log2(TPM值)。(C)Ssk和Ssk-FB4蛋白水平的表达量。(D)Ssk-FB4/Ssk蛋白非同义突变积累分布图。(E)Ssk和Ssk-FB4蛋白与Mesh蛋白免疫共沉淀前后的蛋白定量数据。与母本基因Ssk不同,Ssk-FB4与Mesh互作水平较弱,暗示其具有新功能。(F)黑腹果蝇DGRP品系在真菌Metarhizium anisopliae Ma549感染后的寿命半衰期值。
1812年,法国皇帝拿破仑一世从俄罗斯莫斯科撤退时,其大部分军队因饥饿、疾病和寒冷的冬天而损失殆尽。如今,对这撤退途中丧生的30万士兵的部分遗骸的DNA的分析发现,两种未曾预料到的细菌性疾病很可能增加......
1812年夏,法兰西皇帝拿破仑·波拿巴率50万大军入侵俄罗斯帝国。然而到12月时,这支军队仅余零星残部。历史记载将此次“全军覆没”归因于饥寒交迫与斑疹伤寒。但一项新研究表示,从士兵牙齿中提取的DNA,......
美国北卡罗来纳大学研究团队研发出一种名为“DNA花朵”的微型机器人。这种机器人具有独特的自适应环境变化能力,能够像生物体一样,根据周围环境改变形状和行为。“DNA花朵”机器人由DNA与无机材料结合形成......
瑞士苏黎世联邦理工学院科学家在最新一期《自然》杂志上发表论文称,他们开发出一款名为MetaGraph的DNA搜索引擎,能快速、高效地检索公共生物学数据库中的海量信息,为研究生命科学提供了强大的专业工具......
究竟是什么让人脑与众不同?美国加州大学圣迭戈分校研究团队发现了一个名为HAR123的小型DNA片段,这将是解开人类大脑独特性之谜的关键。相关研究成果发表于新一期《科学进展》杂志。最新研究表明,HAR1......
究竟是什么让人脑与众不同?美国加州大学圣迭戈分校研究团队发现了一个名为HAR123的小型DNA片段,这将是解开人类大脑独特性之谜的关键。相关研究成果发表于新一期《科学进展》杂志。最新研究表明,HAR1......
基因组编辑技术作为生命科学领域的一项重要突破,为基础研究和应用开发提供了技术支撑。以CRISPR及其衍生技术为代表的编辑系统通过可编程的向导RNA引导Cas9等核酸酶靶向基因组特定位点,被广泛应用于特......
神经元中基因编辑的插图。图片来源:杰克逊实验室哪怕在五年前,人们也会认为在活体大脑中进行DNA修复是科幻小说中才有的情节。但现在,科学家已能进入大脑、修复突变,并让细胞在整个生命周期中维持住这种修复效......
国际知名学术期刊《自然》北京时间7月2日夜间在线发表一篇基因组学论文称,研究人员从上埃及Nuwayrat地区一个古王国墓葬中提取到一名古埃及个体的全基因组测序数据,这些数据分析可追溯至古埃及第三至第四......
在一项研究中,科学家对埃及一座墓葬中的一名古埃及人进行了全基因组测序。这些数据可追溯至古埃及第三至第四王朝,揭示了其与北非及中东地区,包括美索不达米亚古人群的亲缘关系,为早期埃及人的遗传多样性研究提供......