免疫疗法方兴未艾,并在肿瘤治疗中展现出极佳的治疗效果,而抗肿瘤T细胞疗法是免疫疗法的重要代表。
细胞毒性CD8 T细胞可以直接杀死肿瘤细胞,是在临床使用的许多免疫治疗方法中动员的关键武器。然而,肿瘤组织能够创造严酷的微环境,招募免疫调节细胞,并诱导抑制T细胞功能的信号分子的产生,从而阻碍了T细胞的功能、聚集和肿瘤浸润。
这些研究表明抗肿瘤T细胞疗法的疗效会因为肿瘤组织的抵抗性反应而逐渐衰弱,那么,我们该如何去规避这一现象的发生呢?
2019年12月11日,美国田纳西州孟菲斯圣犹达儿童研究医院迟洪波团队在 Nature 杂志上发表了题为:Targeting REGNASE-1 programs long-lived effector T cells for cancer therapy(以REGNASE-1为靶点的重编程长寿命效应T细胞用于癌症治疗)的研究论文。
论文研究发现,REGNASE-1蛋白的缺失延长了抗肿瘤CD8 T细胞的存活,增强了它们的功能,使T细胞能够更好地、更有效地与癌症作斗争。
免疫细胞抗肿瘤疗法深刻地改善了对某些恶性肿瘤的治疗,最常见的便是过继性T细胞治疗(ACT)。这种方法依赖于从人的血液或肿瘤中取出的T细胞,在实验室进行刺激以诱导分裂分化甚至修改细胞表面受体,使其转化为抗肿瘤T细胞,再回输到病人体内,从而杀伤患者体内的肿瘤细胞。例如,CAR-T疗法,在T细胞上表达一种专门针对肿瘤细胞的受体——嵌合抗原受体(CAR-T),这一疗法在治疗白血病等血液肿瘤上是非常成功的。
尽管免疫细胞疗法具有巨大的潜力,但目前ACT的治疗效用是有限的,因为回输到患者体内的改良T细胞往往仅能短暂存在,而且常常无法克服肿瘤组织的抵抗性作用。正常情况下,机体内抵抗了病原体或肿瘤细胞后,会留下一类被称为记忆T细胞长寿命细胞,它们是自我更新的,如果再次遇到相同的感染或恶性肿瘤,它们可以迅速增殖产生大量的细胞毒性CD8 T细胞。然而,如果不能消除感染或肿瘤,细胞毒性T细胞将逐渐失去其功能(称为exhaustion的过程)。
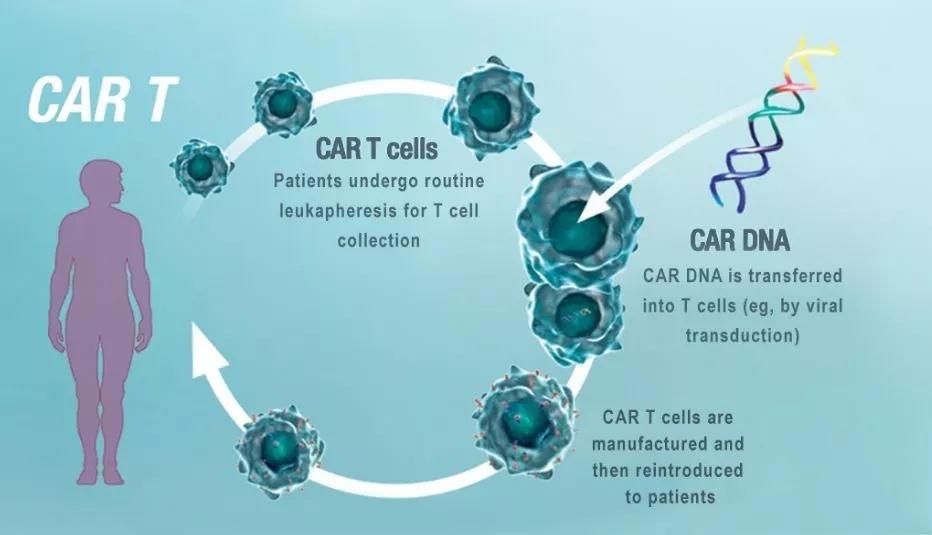
用于ACT的理想T细胞群能够浸润肿瘤并大量积累,同时保留细胞毒性功能和自我更新能力。但T细胞分化为细胞毒性CD8T细胞损害了成功保留了形成长期记忆细胞的潜力。研究者于是提出了这样一个问题:是否有一种策略可以在ACT的T细胞中诱导出这两种有益的性状。
研究表明,在复杂的肿瘤微环境中,CD8 T细胞需要有强烈的新陈代谢,以维持生存所需的营养和能量需求,从而保持其抗肿瘤活性。
于是该团队等利用CRISPR/Cas9文库筛选技术敲除了3000多个与T细胞代谢相关的基因,在小鼠抗肿瘤ACT模型中对这些基因的功能进行了检测。研究团队鉴定了200多个基因,这些基因可以显著影响转移到荷瘤小鼠体内的CD8 T细胞的持久性和功能。许多基因的破坏会对细胞的存活能力产生负面影响,从而在肿瘤中积累,但有4个基因的破坏会导致更多的T细胞浸润肿瘤组织。
这4个基因中作用最显著的是编码REGNASE-1酶的基因,该酶与RNA结合并降解RNA,从而影响免疫应答,但其在CD8 T细胞抗肿瘤作用中的作用尚未见报道。REGNASE-1缺失的CD8 T细胞在肿瘤组织中的积累量是正常CD8 T细胞的2000倍。缺乏REGNASE-1的CD8 T细胞比野生型CD8 T细胞能更好地对抗两种肿瘤——黑色素瘤和急性淋巴细胞白血病。
为了更好地理解REGNASE-1缺失导致T细胞在肿瘤组织中持续性增加的原因,作者分析了REGNASE-1缺陷型细胞和野生型细胞的基因表达谱。REGNASE-1的缺失与记忆T细胞分子特征的增加有关,表明存在比正常群体更大的长寿命记忆样细胞,这些细胞可快速增殖产生细胞毒性CD8 T细胞。
Regase-1缺失的CD8T细胞表现为线粒体功能显著增加(线粒体是提供细胞能量的关键来源的细胞器),包括产生能量和消耗氧气的能力。这是十分值得注意的,因为这种能力在抗肿瘤T细胞中经常受到损害。
REGNASE-1缺陷的这些联合效应若能应用于ACT的CD8 T细胞和CAR-T细胞,那么便能使ACT免疫疗法产生质的飞跃——重编程T细胞在靶向的癌症中积累并随时间保持活性。
为了进一步了解这一机制,研究团队使用CRISPR/Cas9敲除文库来破坏REGNASE-1缺陷的CD8 T细胞中的大约20000个基因,以查明介导REGNASE-1依赖性细胞重编程的关键下游基因。
转录因子BATF是CD8 T细胞分化的关键调控因子,它的失活使缺乏REGNASE-1的T细胞的长寿命和与线粒体相关的高表达基因不复存在。作者发现,REGNASE-1与PTPN2或SOCS1两种蛋白的联合缺失具有协同效应,与仅缺失REGNASE-1的T细胞的特性相比,更能增加T细胞的持久性、积累量和抗肿瘤活性。
研究团队报道了REGNASE-1缺失的肿瘤记忆样细胞和细胞毒性CD8 T细胞中,其细胞毒性蛋白的表达均高于野生型CD8 T细胞。具有记忆性质的野生型细胞一般不会直接杀死肿瘤细胞,而REGNASE-1缺失记忆样T细胞是否仅具有自我更新和增殖产生细胞毒性CD8-T细胞群的功能,或是否也能直接介导肿瘤细胞杀伤尚不清楚。
如果REGNASE-1缺失的记忆样T细胞拥有杀伤肿瘤细胞的能力,那么它又是如何保持自身活性的呢?更有趣的是,研究者表示,REGNASE-1缺失的CD8 T细胞需要遇到特异性识别的肿瘤抗原才能持续保持活性。这可能解释了为什么抗肿瘤T细胞相比于富含T细胞难以接触到肿瘤抗原的脾脏组织,更显著地在小鼠肿瘤组织中的聚集。
肿瘤微环境中的其他因素是否有助于增强REGNASE-1缺失CD8 T细胞的持久性仍有待研究。为此,对REGNASE-1、PTPN2、SOCS1和BATF组合性缺失的CD8 T细胞的代谢特征进行评估可能具有极好的参考价值。
这将有助于我们了解这些蛋白对CD8T细胞代谢重编程的影响,以及这对细胞分化和抗肿瘤功能的重要性。此外,在这种情况下找到相关的代谢物可能会为这些CD8 T细胞如何受到营养缺失的肿瘤微环境的影响提供线索。
这项研究为ACT免疫疗法的发展提供了重要的理论依据。十分值得去尝试在CAR-T细胞的制造过程中,利用CD8 T细胞来删除或表达低水平的REGNASE-1基因,并观察其可行性。
最后,鉴于肿瘤细胞中PTPN2的抑制使其对免疫治疗更具敏感性,那么我们是否可以在ACT免疫疗法中以REGNASE-1 CD8 T细胞和PTPN2抑制剂进行联合治疗,从而使肿瘤免疫治疗的疗效更强大、更持久。
暨南大学基础医学与公共卫生学院教授罗钧洪团队基于变分自编码器深度学习框架开发了人工智能模型Multi-InsightforTcell(MIST),针对scRNA-seq与scTCR-seq数据的联合分......
3月25日,记者从汕头大学医学院附属肿瘤医院获悉,该院放疗科副主任陈创珍团队与法国古斯塔夫·鲁西癌症中心等机构合作,研究发现肠道低剂量放疗能克服恶性肿瘤免疫耐药。相关成果发表于《癌细胞》(Cancer......
中国科学院上海营养与健康研究所、中国科学院上海药物研究所等单位的研究人员合作,揭示了衰老影响机体CD8+T细胞抗肿瘤免疫反应的作用和分子机理,探究了衰老个体和PD-1抗体治疗不响应患者的肿瘤免疫防御能......
近日,记者从北京协和医院获悉,该院肝脏外科副主任(主持工作)杜顺达教授团队为一名乙肝相关肝癌的晚期患者进行了特异性T细胞免疫治疗并长期随访观察。据悉,这是全球首例乙肝特异性T细胞疗法在晚期肝癌患者中的......
近日,记者从北京协和医院获悉,该院肝脏外科副主任(主持工作)杜顺达教授团队为一名乙肝相关肝癌的晚期患者进行了特异性T细胞免疫治疗并长期随访观察。据悉,这是全球首例乙肝特异性T细胞疗法在晚期肝癌患者中的......
近日,《美国化学会·纳米》在线发表中国科学院院士、国家纳米科学中心研究员陈春英课题组在抗肿瘤纳米药物研究领域的最新成果。该团队首次在乏氧肿瘤细胞表面形成纳米纤维状水凝胶结构,抑制肿瘤外泌体扩散,同时携......
“做老百姓吃得起的好药,让中国原创新药早日走向世界。”在上海市浦东新区张江科学城内,有一处被誉为“张江药谷”的地方。这里汇集了包括中国科学院上海药物研究所(以下简称上海药物所)在内的一批药物研发中心,......
氨被认为是一种细胞毒素,它在血液中的增加会损害细胞功能。然而,这种毒素是否以及如何在病理生理条件下引发细胞死亡仍不清楚。2024年9月11日,华中科技大学黄波团队在NatureCellBiology(......
9月11日,《自然-细胞生物学》发表了华中科技大学黄波教授团队有关T细胞死亡的研究成果。研究发现,CD8+T细胞激活的过程中细胞内氨逐渐积累最终导致T细胞死亡。据悉,这一独特死亡方式的分子机制,为异己......
8月28日,上海市药监局发布了《上海市自体嵌合抗原受体T细胞(CAR-T)治疗药品监督管理规定》以及这一监管规定的政策解读通知,本规定自2024年9月1日起施行,有效期5年,有效期至2029年8月31......