甲亢是一种常见的器官特异性自身免疫性疾病,是由于甲状腺合成释放过多的甲状腺激素,造成机体代谢亢进和交感神经兴奋。甲亢病因很多,与情绪,碘营养,自身免疫,家族遗传性都有关系,常见的有弥漫性毒性甲状腺肿(又称Graves’ disease,GD)、炎性甲亢、药物致甲亢、HCG相关性甲亢和垂体TSH瘤甲亢,其中以Graves甲亢最为常见,约占所有甲亢的60%~80% 。
Graves甲亢每年发病率约为万分之四,其发病关键是在环境与遗传因素的相互作用下,机体免疫系统产生了针对促甲状腺激素受体 (TSHR) 的自身抗体(TSAb),TSAb与TSHR的结合激活下游信号级联反应,模仿TSH持续刺激的效果,从而导致甲状腺功能亢进,若不及时治疗,会导致高发病率和死亡率。此外,Graves甲亢相关眼病折磨着大约50%的患者,尤其难以治疗。目前GD发病机制尚不明确,建立符合GD发病特点的动物模型,对疾病的诊断及治疗研究都具有重要意义。外源性甲状腺素补充法和免疫诱导甲状腺肿是建立诱发性甲亢动物模型的主要方法,其中以表达人TSHR-A亚基的重组腺病毒( Ad-TSHR-289) 免疫诱导的甲亢模型是较为理想且使用广泛的GD动物模型。
促甲状腺激素受体(TSHR)
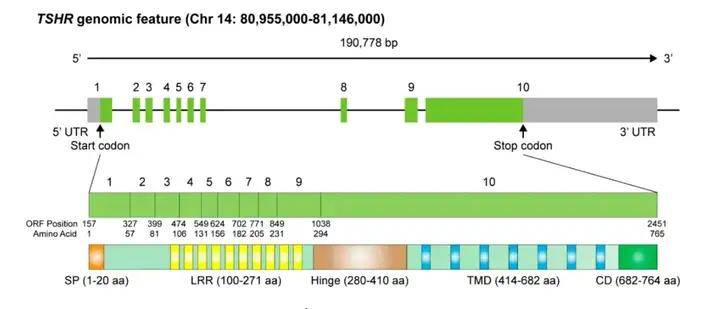
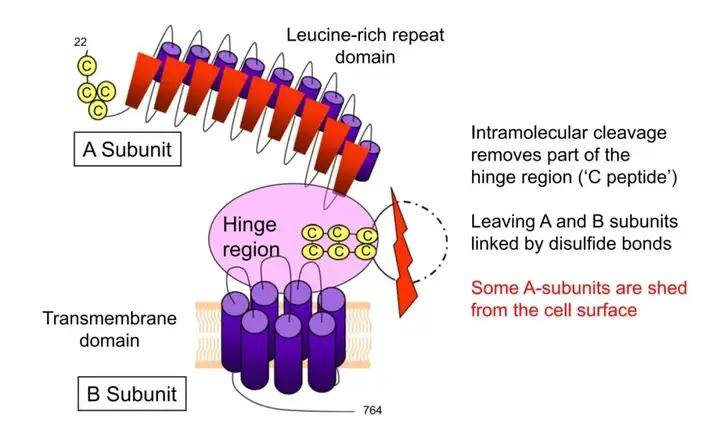
TSHR是一种细胞表面糖蛋白受体,属于G蛋白偶联受体(GPCR)家族成员,由764个氨基酸组成,分子量为87kDa。人类TSHR编码基因位于14号染色体长臂(14q31),基因共含10个外显子,前九个外显子编码胞外庞大的N-端区,该胞外区包含一个富含亮氨酸的重复结构域,通过铰链区与跨膜结构域相连;第十个外显子则编码七个跨膜片段以及胞内短小的C-末端。不同于其他糖蛋白激素受体,TSHR胞外结构域中插入了一个包含50个氨基酸的序列(C肽),在翻译后修饰过程中,金属蛋白酶介导的分子内裂解作用使TSHR的N-端胞外结构域与跨膜螺旋结构域分离,C肽序列被移除,使TSHR转化为通过二硫键连接的A亚基(289aa)和B亚基。
TSHR基因组结构示意图
TSHR蛋白结构示意图
TSHR主要在甲状腺细胞中表达,天然配体是TSH。生理状态下,TSHR胞外结构域抑制跨膜螺旋结构域的活性,当胞外结构域被TSH特异性结合,其构象改变转化为跨膜螺旋结构域的激动剂,从而导致TSHR激活,并引起下游细胞内信号级联反应,以控制甲状腺生长以及甲状腺激素的合成与分泌。病理条件下,TSHR结构发生异常改变,在酶解作用下连接A、B两个亚基的二硫键发生溶解断裂,TSHR-A亚基脱落表达于细胞表面,诱发并增强自身免疫反应,使TSHR作为自身抗原激发机体产生抗体TSAb从而导致甲亢的发生。因此,具有免疫原性的TSHR-A亚基是诱发自身免疫反应的关键,针对TSHR-A亚基的研究成为GD模型研究的热点。