泛素-蛋白酶体系统(ubiquitin-proteasome system)参与调控真核细胞内众多的生物进程,包括蛋白质质量控制、细胞周期维持、基因表达调控、应激反应等【1,2】。其功能的异常与癌症、神经退行性疾病、自身免疫病等人类重大疾病密切相关【3】。26S蛋白酶体是一种依赖于ATP的蛋白酶,通过降解泛素化底物来调节真核细胞的蛋白质组。长度为4个及以上的Lys48 (K48) 连接的泛素链是生理条件下蛋白酶体的主要靶向信号【4,5】。因此,解析K48连接的多泛素链与蛋白酶体结合形成复合体的三维结构,将为深入理解泛素链结合引起蛋白酶体构象变化进而引发底物降解的分子机制提供关键信息。
然而,由于蛋白酶体存在泛素链的多个结合位点以及蛋白酶体自身的动态特性,给捕获初始阶段蛋白酶体识别并结合多聚泛素链的状态带来极大挑战,迄今为止,非锚定K48-Ub4泛素链(free unanchored K48-Ub4 chain)在完整蛋白酶体结构中的结合位置尚不清楚。因此,由泛素链结合引发的蛋白酶体底物降解的分子机制亟待阐明。
2019年2月18日,中国科学院上海生物化学与细胞生物学研究所丛尧研究组在Molecular Cell发表了题为Structural snapshots of 26S proteasome reveal tetraubiquitin-induced conformations的研究论文,解析了一系列蛋白酶体在K48-Ub4泛素链存在下的近原子分辨率冷冻电镜结构,首次捕捉到蛋白酶体与K48-Ub4泛素链结合的三维结构,揭示了泛素链在调节蛋白酶体识别泛素化底物进而引发底物降解的分子机制,为最终阐明生理条件下蛋白酶体降解泛素化底物机制提供了关键结构基础。

在该项研究中,丛尧研究组依托国家蛋白质科学中心(上海)的先进冷冻电镜设施,解析了一系列K48-Ub4泛素链引发的蛋白酶体新构象的冷冻电镜结构,其中三个结构达到近原子分辨率水平。通过与相关结构的比对 【6】,研究人员定义了一个全新的静息态构象C1-b。与以往的静息态构象不同的是C1-b具有更为稳定的泛素受体(如Rpn1,Rpn10),同时其19S调节颗粒的外围亚基有向Rpn1靠近的趋势。上述变化趋势可能由泛素链的结合引起,从而起始整个蛋白酶体从静息态向激活态的转变。研究人员将C1-b定义为泛素接受状态(Ub-accepted state)。
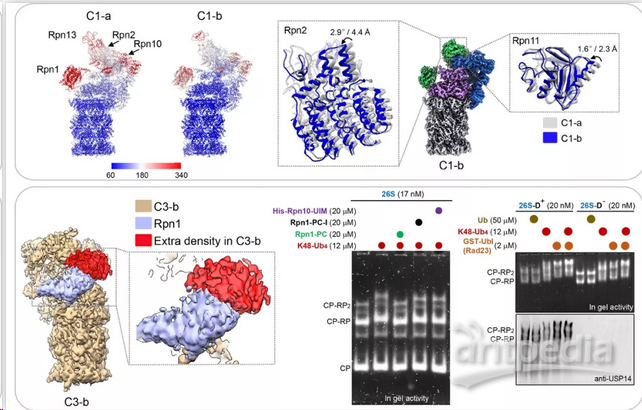
更为有趣的是在蛋白酶体激活态的三个构象中,研究人员首次捕捉到了完整蛋白酶体与K48-Ub4结合的构象C3-b,揭示了K48-Ub4泛素链结合在蛋白酶体Rpn1亚基的整个PC环形区域(PC toroid region),这与单泛素或泛素样蛋白(UBL)的结合模式显著不同。同时,与以色列Technion-Israel Institute of Technology 的Michael H. Glickman教授研究团队合作的功能研究显示K48-Ub4与具有泛素样结构域的shuttle泛素受体Rad23及去泛素化酶Ubp6可同时占据Rpn1,揭示了全新的泛素传递机制。另外,C3-b结构具有连续的底物转运通道及打开的20S门控,表明其具备底物降解条件,从而被定义为底物处理状态(substrate-processing state)。
之后,研究人员分析了这五个结构的构象变化,尤其侧重于19S调节颗粒的lid、base区域,及20S核心颗粒的门控区域,揭示了19S调节颗粒识别并结合泛素链,引发的变构通过Rpn6-α2 亚基传递到20S核心颗粒,最终打开门控的远程调控机制。
综上所述,该研究揭示了K48-Ub4泛素链结合对于整个蛋白酶体的变构调节作用,首次捕捉到蛋白酶体与K48-Ub4泛素链相结合的构象,发现了泛素链与完整蛋白酶体独特的结合模式,并提出了全新的泛素传递机制,进而揭示了泛素链结合在引发蛋白酶体底物降解过程中的调节机制。该研究为最终阐明生理条件下蛋白酶体降解泛素化底物的分子机制奠定了基础,并为深入理解蛋白酶体降解泛素化底物缺陷而引起疾病的机制,进而探索相关疾病的诊疗手段提供理论基础。
据悉,丛尧组博士后丁占玉为本文第一作者,丛尧研究员为通讯作者。参与该工作的还有以色列Technion-Israel Institute of Technology的Michael H. Glickman教授团队,以及国家蛋白质科学中心(上海)的黄超兰教授(现在北京大学)团队。该研究得到了生化细胞所张荣光、周兆才、周金秋研究员的大力支持。
7月2日,中国科学院上海药物研究所研究员谭敏佳课题组和江苏海洋大学教授刘彬团队合作,在CellDeath&Differentiation上,在线发表了题为Globalidentificatio......
泛素化作为最为复杂的蛋白质翻译后修饰形式之一,在多种细胞过程中发挥关键调控作用。经典的泛素化过程依赖于E1-E2-E3酶高度有序的级联反应来完成。其中,泛素E3连接酶直接负责识别底物蛋白并将其泛素化,......
自交不亲和性(Self-incompatibility,SI)是一种广泛存在于显花植物中的种内生殖障碍。前期研究表明,茄科、车前科、蔷薇科和芸香科植物花柱特异表达的S-RNase可作为一类细胞毒因子抑......
人类基因组包含大约31.6亿个DNA碱基对,线性DNA分子作为庞大遗传信息的载体一般都比较长(人类一条染色体的DNA长度约为2米),生命通过组蛋白将DNA分子有序组织压缩形成微米级别的染色质存储到细胞......
类黄酮是植物界广泛存在的次生代谢产物,具有包括使植物器官和组织着色、吸引昆虫传粉、抵御紫外线伤害等一系列重要的生物学功能。近年来,类黄酮的药用价值和保健功能备受关注。科学家对植物中的类黄酮合成途径在转......
胶质母细胞瘤(GBM)是最常见和破坏性的人脑恶性肿瘤,其特征在于广泛的肿瘤内异质性。尽管最近在多模式治疗方面取得了进展,但GBM患者的结果仍然令人沮丧。GBM拥有一个细胞亚群,称为GBM干细胞(GSC......
泛素-蛋白酶体系统(ubiquitin-proteasomesystem)参与调控真核细胞内众多的生物进程,包括蛋白质质量控制、细胞周期维持、基因表达调控、应激反应等【1,2】。其功能的异常与癌症、神......
泛素-蛋白酶体系统(ubiquitin-proteasomesystem)参与调控真核细胞内众多的生物进程,包括蛋白质质量控制、细胞周期维持、基因表达调控、应激反应等【1,2】。其功能的异常与癌症、神......
Scripps研究所的科学家们破译了蛋白酶体如何将能量转换为机械运动,从而对蛋白质展开破坏行动的秘密。文章发表在《Science》杂志,有助于理解蛋白酶体相关疾病,比如帕金森综合征和阿尔兹海默症等。“......
蛋白酶体是细胞中用来调控特定蛋白质的浓度和清除错误折叠蛋白质的主要机制的核心组成部分,是细胞中最普遍的不可或缺的大型全酶超分子复合机器之一,也是迄今为止发现的最大的蛋白降解机器。北京大学物理学院/定量......