在细胞治疗过程中,评价免疫细胞的增殖能力,以其对靶细胞的杀伤能力是细胞治疗过程中非常关键的环节。其中DELFIA® EuTDA细胞毒法和DELFIA® BrdU细胞增殖方法,凭借其高灵敏度、易操作性性等诸多优势,已逐渐成为主流的检测技术。在此,通过以下一系列的应用案例,我们将向大家展示DELFIA® EuTDA、DELFIA® BrdU、活体影像及放射性检测等方法如何助力免疫细胞杀伤研究。
一,CAR-T细胞杀伤
毫无疑问,CAR-T疗法已成为当下最火的肿瘤细胞疗法之一。同样作为CAR-T大国,中国多数CAR-T疗法已进入临床研究,并且产业化发展迅速,而美国则还集中在临床前研发[1]。

安全性是CAR-T疗法的一大挑战。除了细胞因子风暴外,CAR-T疗法还会诱发移植物抗宿主反应 (graft versus host disease GVHD)等安全隐患。鉴于选择性去除CD45RA阳性细胞能有效抑制GVHD发生[2],研究利用CD45RA阴性T细胞群体开展靶向CD19的 CAR-T疗法,来提高治疗安全性。结合DELFIA的细胞杀伤检测法和基于Calcein-AM标记的流式法,研究证明CD45RA阴性 CAR-T细胞能有效杀伤CD19阳性肿瘤细胞系,并能作用于原代NK细胞杀伤耐受的MLL重排白血病原始细胞SJ4-11(K562为敏感细胞对照,RS4;11为耐受细胞对照)[3]。

由于CD45RA-细胞主要为CD3+CD45O+记忆T细胞,因此针对常见的病原体和疫苗应有更好的回忆应答(Recall response)。通过使用DELFIA Cell Proliferation Assay 检测掺入的BrdU,研究确认CD45RA- T细胞对人CMV、Epstein–Barr 病毒、 herpes simplex 病毒和tetanus toxoid有更为显著的免疫反应(下图a,增殖指标)。基于同样的增殖检测平台,研究利用PBMC开展Mixed lymphocyte reaction (MLR),对比不同细胞亚群的同种异体反应。相较于CDRA-效应细胞群体,CD45RA+细胞在MLR实验中具有更高的增殖能力(下图b)和IFN-γ分泌能力(下图c)[3]。

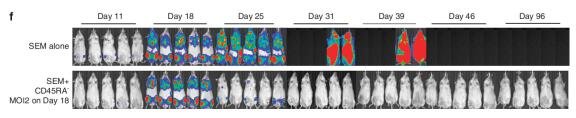
进一步的体内实验研究继续利用了PerkinElmer IVIS活体成像平台,在白血病小鼠模型的基础上,研究证明CD45RA-的 CAR-T疗法在不诱导GVHD的同时,发挥强效的抗癌效果[3]。借助活体成像的优势,研究追踪CD19+ SEM细胞在小鼠体内的扩增情况,确认在接种18天后肿瘤的信号强度足以模拟顽固性白血病小鼠模型。在此模型的基础上CD45RA-的 CAR-T疗法同样能迅速发挥作用,两周内强力抑制生物发光信号至检测限以下。最后,基于同样的检测平台结合重复接种肿瘤细胞,研究证明CD45RA-的 CAR-T疗法还能作用于复发白血病小鼠模型。
二,CAR-NK细胞杀伤
CAR-T细胞疗法的成功和兴起也推动了其他类型的CAR研究,其中就包括针对实体瘤的CAR-NK疗法。相较于T细胞,NK细胞可以在没有抗体和MHC的帮助下靶向疾病细胞,因此能发动更为快速的免疫反应并能有效针对无MHC I表达的肿瘤细胞。同时, NK细胞更为安全,支持“Off-the-Shelf”的大规模生产和直接异体治疗。目前在国内已有多家医疗企业推动CAR-NK治疗,如博生吉的CD7 CAR-NK。
在6月份的Molecular Therapy期刊上,广州医科大学附属第三医院的研究向我们展示了最新的CAR-NK临床应用。为了特异靶向肿瘤细胞表面抗原NKG2DLs,研究在NKG2D受体的胞外结构域基础上融合参与NK细胞活化的核心分子DAP12,并进一步通过RNA转染途径提升CAR-NK安全性。基于DELFIA的细胞杀伤检测法,研究证明NKG2D-DAP12 (NKG2Dp)能有效的裂解多种肿瘤细胞系,优于对照NK和NKG2D-CD3z(NKG2Dz)[4]。

借助Perkinelmer提供的HCT116-luc报告细胞系,研究通过活体成像方法,在体内水平证明CAR-NK能有效控制肿瘤发展。进一步的临床研究证明CAR-NK的引入能迅速引起肿瘤退缩和肿瘤细胞减少,强调NKG2D CAR是一种很有前景的细胞治疗方案[4]。

三,T细胞杀伤
T细胞不仅是免疫系统的核心成员,也是适应性免疫反应的基石。因此,T细胞功能的全面评价在肿瘤免疫疗法的开发过程中至关重要,其中就包括肿瘤疫苗的研发。早期基于经典肿瘤相关抗原gp100的研究证明细胞因子RANTES的引入能显著提升小鼠脾脏细胞的杀伤能力。同时,RANTES表达的时间点非常关键。疫苗引入前12和24小时表达RANTES能有效提升T细胞的杀伤能力,而48小时则没有这个现象。基于动物实验,研究推测多种细胞参与杀伤,包括CD8+,NK细胞和CD4+细胞群体。进一步基于DELFIA细胞毒法研究证明TRAIL和FasL参与了杀伤过程[5]。

除了传统T细胞杀伤外,DELFIA细胞毒法还可以被用于检测靶向T细胞的新型免疫治疗分子,如双特异抗体(BiTE)等的细胞杀伤功能[6]。

四,NK细胞杀伤
鉴于NK细胞在天然免疫系统的重要性,其活力检测也是免疫检查点抑制剂研发过程中的核心项目。此外,NK细胞活力检测还可以用于衡量用于免疫疗法开发的新型小鼠模型。在2016年发表的一份研究中,基于DELFIA的细胞杀伤检测法证明PD-1抗体可以显著提升NOG-MHC Double Knockout小鼠脾中NK细胞靶向K562的杀伤活力。靶向免疫治疗的新小鼠模型不仅能加速新型免疫检查点药物(组合)研发,同时可以协助发现新的标志物预测疗效[7]。

除了直接杀伤靶细胞外,抗体依赖的细胞介导的细胞毒性作用(Antibody-dependent cell-mediated cytotoxicity,ADCC)也是评价NK细胞功能的一个关键指标。在今年的一份研究中,DELFIA细胞毒法被用于衡量静脉注射免疫球蛋白( intravenous immunoglobulin, IVIG)对NK细胞功能的影响。从结果可以看出,除了阻断NK细胞的直接杀伤能力外,IVIG几乎完全抑制ADCC活力(下图上)[8]。在该研究中,除了ADCC检测外,Perkinelmer的放射检测解决方案(3 [H]-Thymidine和MicroBeta 2)也被用于衡量IVIG和免疫抑制药物对NK细胞增殖的影响。H3-掺入法证明相较于IVIG,免疫抑制药物能有效抑制NK细胞增殖(下图下),而IVIG则特异作用于T细胞活力。鉴于ADCC是单抗药物发挥临床效果的核心机制之一,其活力检测也成为大分子药物研发的必须环节[9]。

参考资料:
[1] Jia Xin Yu, et al. The global pipeline of cell therapies for cancer. https://www.nature.com/articles/d41573-019-00090-z
[2] Triplett BM, et al. Rapid Memory T-cell Reconstitution Recapitulating CD45RA-depleted Haploidentical Transplant Graft Content in Patients with Hematologic Malignancies. Bone Marrow Transplant. 2015 Jul; 50(7): 968–977.
[3] Chan WK, et al. Chimeric antigen receptor-redirected CD45RA-negative T cells have potent antileukemia and pathogen memory response without graft-versus-host activity. Leukemia. 2015 Feb;29(2):387-95.
[4] Xiao L, et al. Adoptive Transfer of NKG2D CAR mRNA-Engineered Natural Killer Cells in Colorectal Cancer Patients. Mol Ther. 2019 Jun 5;27(6):1114-1125.
[5] Aravindaram K, et al. Transgenic expression of human gp100 and RANTES at specific time points for suppression of melanoma. Gene Ther. 2009 Nov;16(11):1329-39.
[6] Lewis SM, et al. Generation of bispecific igG antibodies by structure-based design of an orthogonal Fab interface. Nat Biotechnol. 2014 Feb;32(2):191-8.
[7] Ashizawa T, et al. Antitumor Effect of Programmed Death-1 (PD-1) Blockade in Humanized the NOG-MHC Double Knockout Mouse. Clin Cancer Res. 2017 Jan 1;23(1):149-158.
[8] Pradier A, et al. Small-Molecule Immunosuppressive Drugs and Therapeutic Immunoglobulins Differentially Inhibit NK Cell Effector Functions in vitro. Front Immunol. 2019 Mar 27;10:556.
[9] DELFIA经典技术应用于单抗研发及细胞治疗——AD0116细胞杀伤专题之ADCC; https://mp.weixin.qq.com/s/0lkBdDHL5MFIyoeoFV4wWQ
本研究探讨了PDPN在黑色素瘤中的作用,证实PDPN通过激活Wnt/β-catenin通路促进黑色素瘤的生长和转移。黑色素瘤是一种皮肤癌,主要是由于黑色素细胞的突变和随后不受控制的增殖引起的。虽然黑色......
墨尔本大学的LauraMackay教授领导的研究人员发现了控制不同类型免疫细胞的不同机制,并发现通过精确地针对这些机制,他们可以选择性地消除“有问题的细胞”,重塑皮肤的免疫格局。我们的皮肤上布满了专门......
在一项新的研究中,来自日本九州大学的研究人员发现将大脑中称为小胶质细胞的免疫细胞直接转化为神经元可成功恢复小鼠中风样损伤后的大脑功能。这一发现表明,利用免疫细胞补充神经元可能是治疗人类中风的一条很有前......
肥胖是一种世界性流行病,导致代谢紊乱的发病率增加,包括胰岛素抵抗、2型糖尿病、高血压和各种形式的癌症。目前,肥胖的主要治疗方法包括改变生活方式和药物干预以及减肥手术。不幸的是,尽管这些治疗方法中的许多......
NIBS/清华大学汤楠及浙江大学/南京医科大学陈静瑜共同通讯在CellDiscovery(IF=34)在线发表题为“Aberrantdifferentiationofepithelialprogeni......
澳大利亚奥莉维亚纽·顿-约翰癌症研究所科学家在6日出版的《科学免疫学》杂志上发表论文称,他们发现了预防和治疗肠癌的新靶标:TCF-1分子。研究表明,删除免疫细胞内的TCF-1时,会导致肠癌肿瘤显著减少......
澳大利亚奥莉维亚纽·顿-约翰癌症研究所科学家在10月6日出版的《科学免疫学》杂志上发表论文称,他们发现了预防和治疗肠癌的新靶标:TCF-1分子。研究表明,删除免疫细胞内的TCF-1时,会导致肠癌肿瘤显......
肠道中一组特殊的免疫细胞可能在控制克罗恩病进展中发挥关键作用。克罗恩病是炎症性肠病(IBD)的两种主要形式之一,这两种疾病总共影响了英国和美国大约1%的成年人。然而,伦敦弗朗西斯·克里克研究所的Adr......
免疫细胞作为防止病毒细菌等病原体入侵人体的“卫士”,是免疫系统中不可或缺的组成部分。明确免疫细胞类型、分化及功能状态,对理解免疫力和揭示免疫相关疾病的发生发展机制具有重大的科学和社会意义。9月12日,......
叉头框P3(Foxp3,ForkheadboxP3)是一种特殊的转录因子,其能影响调节机体外周免疫反应的调节性T细胞(Tregs)的功能,Treg所介导的先天性免疫和Treg所介导的适应性免疫往往因其......