(四)《指导原则》的核心内容
在这份长达48页的《体外伴随诊断设备与治疗产品的共同开发指导原则》(草案)中,最重要的部分莫过于第三大部分——共同开发过程的原则,其中包括体外诊断和治疗产品的监管条例 、潜在合作发展项目的IVD验证计划、治疗产品临床试验设计注意事项、晚期期治疗产品的IVD开发注意事项、标签注意事项以及上市前注意事项等。
其中,关于治疗产品临床试验与IVD的产品验证试验中,需要注意的事项尤为重要,本文仅用以下两个图表进行解读。在进行伴随诊断产品开发及申报过程中,可以参照大纲内容进行文档索引。
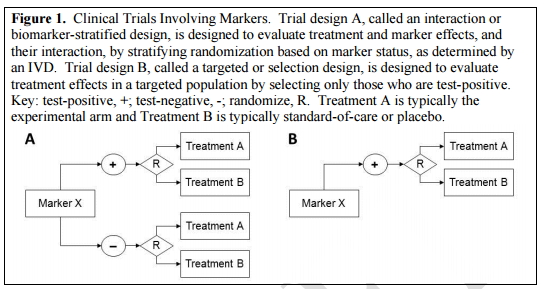
注:图中“+”指阳性,“-”指阴性,R指随机,A代表实验组,B代表安慰剂组
众所周知,在开发伴随诊断产品时,离不开对标记物进行临床试验的分析与验证。
图1A叫做“生物标志物的分层设计”或“生物标志物的相互作用”,用以评价治疗产品与标记物的效果以及它们之间的相互作用,该方法作为一种IVD产品测试,是基于标志物随机状态下的分层试验;
图1B叫做“靶向设计”或“选择设计”,旨在评估特定人群中,谁能够对治疗方法产生阳性效果的测试。
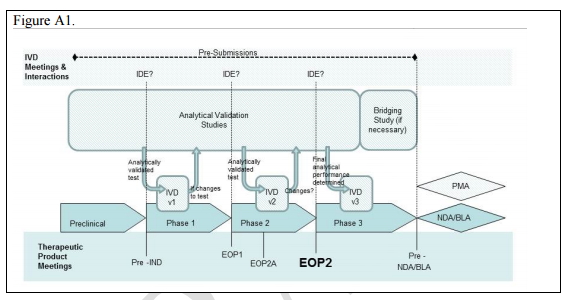
共同开发过程的关键点
毋庸置疑,一种治疗方法的伴随诊断的高效合作方式必须是建立在:两个产品研发项目团队的积极协作,甚至包括FDA系统所有相关部门间的合作与相互交流。
如图1所示:在某个药物/生物制品从临床前研究到NDA/BLA(新药上市许可/生物制品许可申请)过程中,先后需要经过临床前研究,1、2、3期临床试验。
在这个过程中,相应的体外诊断测试也需要同步进行(见图中的IVD v1、IVD v2、IVD v3)。其中针对在临床前研究的完成时(Pre-IND)、1期临床试验结束点(EOP1)和2期临床试验结束点(EOP2)所开发的伴随诊断测试都需要进行医疗器械临床试验申报(IDE)。
在上述的过程中,如何设计相应控制点的目标?如何衡量出现的偏差?谁应对哪些失误负责?哪些信息反馈价值最大、最经济实用等等。具体说来,企业在设计试验时就需要要制定一些客观的标准。
(五)FDA已经批准的28款伴随诊断产品
根据生物探索的前期统计(截止到2016年5月24日),FDA已经批准了一些伴随诊断检测。这些检测由罗氏、雅培、QIAGEN、DAKO等公司推出,主要利用qPCR、原位杂交、免疫组化等方法筛查一些肿瘤相关突变,以协助医生选择适当的疗法。
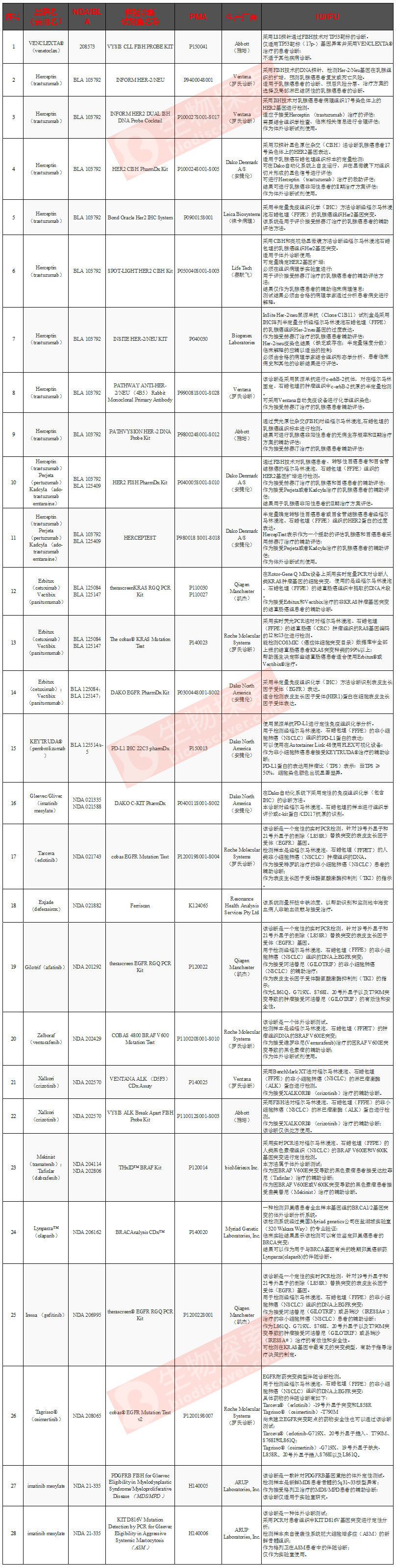
备注:NDA指新药申请;BLA指生物制剂许可申请;PMA指上市前申请许可;IU指预期用途;IFU指使用适应症。
(六)展望:伴随诊断,体外诊断市场发展最快的领域
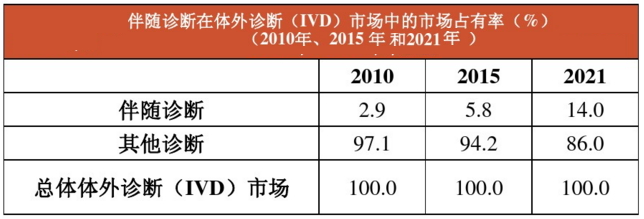
由上图可见,伴随诊断是一个新兴市场,预计到2021年,伴随诊断将占整个体外诊断(IVD)市场14%的份额。
目前已经有越来越多的医疗器械(IVD)公司开始与制药企业展开合作,为后者的在研药物/生物制品开发伴随诊断试剂盒。
作为精准医疗的重要分支,伴随诊断是对于预测患者针对特定药物的治疗反应至关重要。
对尚未或正在准备开展伴随诊断合作,拓宽新兴市场的药企&诊断公司而言,仔细研究FDA发布的这份长达48页的“葵花宝典”,必将让“研发——试验——上市”过程更加顺利。
2023年8月28日,北京——安捷伦科技公司(纽约证交所:A)近日宣布其PD-L1检测试剂盒(免疫组织化学法)(货号SK006)获得伴随诊断(CDx)C类IVDR认证。该CDx检测之前已拥有CE-IV......
2022年5月16日,北京——安捷伦科技公司(纽约证交所:A)近日宣布其PD-L1检测试剂盒(免疫组织化学法)(货号SK006)现已获得欧盟CE-IVD认证,可用于宫颈癌。PD-L1检测试剂盒(免疫组......
近日,美国食品和药物管理局(FDA)计划推出针对个体化抗癌药物伴随诊断的分类标签。本月早些时候,FDA发布了相应的指南草案,概述了该分类标签适用于个体化癌症治疗伴随诊断的情况。该草案描述了当前伴随诊断......
盖伦奖(PrixGalienAward)被公认为制药和生物医疗行业的最高荣誉,旨在褒奖医疗、科学在研究与创新领域所取得的卓越贡献,被誉为“医药界的诺贝尔奖”。为了帮助大家更加深入地了解这些优秀的医疗器......
伴随诊断是一种体外诊断技术,能够提供有关患者针对特定治疗药物的治疗反应的信息,有助于确定能够从某一治疗产品中获益的患者群体,从而改善治疗预后并降低保健开支。伴随诊断行业概况随着个性化医疗和精确治疗时代......
2017年盛夏,基因编辑技术应用的全球领导者HorizonDiscovery公司(伦敦证券交易所:HZD),宣布其与国际知名NGS公司合作的肿瘤伴随诊断试剂盒携Horizon分子诊断标准品成功通过FD......
2016年,默沙东和百时美施贵宝的癌症免疫治疗药物Keytruda及Opdivo全球销售额分别为14亿美元及38亿美元,而随着适应症的进一步扩大以及免疫疗法更多深入人心的试验数据的公布,必将会吸引更多......
近年来,伴随诊断作为治疗的一个组成部分已经引起癌症研究者和制药、生物公司的广泛关注。伴随诊断的重要性在癌症领域尤其凸显,好的生物标志物可以帮助制药公司快速锁定目标以及高效地设计临床实验。摒弃“非选择性......
2016年12月19日,美国食品和药物管理局(FDA)批准了FoundationMedicine公司的FoundationFocusCDxBRCA产品,成为市场上第一个基于二代测序的伴随诊断试剂盒。该......
“癌症治疗的趋势是有针对性的个体化医疗。”在日前于厦门举行的伴随诊断会议上,专家指出,“伴随诊断”和“靶向治疗”是肿瘤个体化精准治疗最重要的两大工具,且伴随诊断相较于化疗更有助于提高某些患者群体的生存......