内质网(endoplasmic reticulum, ER)是真核细胞分泌蛋白和膜蛋白的折叠工厂。细胞内外环境的变化会引起ER稳态(包括蛋白质稳态、氧化还原稳态和钙稳态等)失衡。当ER的蛋白质折叠负担超过折叠能力时就会造成ER应激,此时ER膜上的三个跨膜“传感器”蛋白(IRE1、PERK和ATF6)可启动一系列从ER到核的信号转导途径,从而增强ER蛋白质折叠能力、停滞大多数蛋白质翻译过程或加速蛋白质的降解等,这些细胞事件被统称为未折叠蛋白质响应(unfolded protein response, UPR)。UPR是从转录和翻译水平来调节ER折叠能力,具有天然的延迟性。特别是在分泌活动旺盛的细胞中,ER的蛋白质折叠状态无时无刻不在发生变化,因此近年来, ER应激的早期调节机制逐渐成为本领域的研究前沿。前期工作中,王志珍院士课题组王磊研究员发现分泌途径激酶Fam20C能通过磷酸化ER巯基氧化酶Ero1α来维持内质网氧化还原稳态,在低氧胁迫、还原应激以及泌乳过程中发挥重要作用。Fam20C能否在ER应激过程中调节蛋白质稳态尚不清楚。
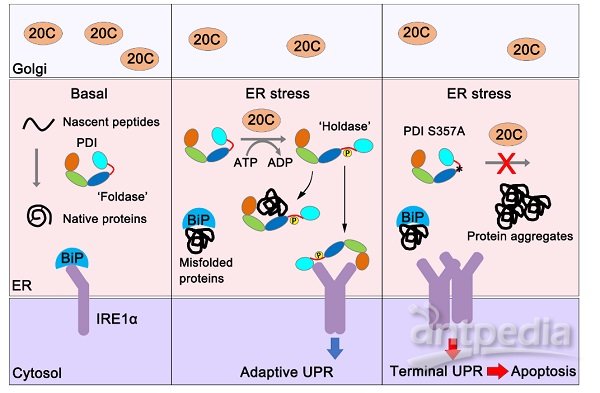
图:Fam20C通过磷酸化PDI诱导其功能转换来维持内质网蛋白质稳态并缓解内质网应激
本工作中,研究人员发现Fam20C缺失能特异增强UPR通路中IRE1信号的上调。通过比较蛋白质组学发现ER应激时Fam20C特异结合并磷酸化ER中负责蛋白质折叠的蛋白质二硫键异构酶(protein disulfide isomerase, PDI)。位于PDI分子x-linker区域的 Ser357是一个关键的磷酸化位点。基于课题组前期解析的PDI晶体结构并结合分子动力学模拟、内外源荧光检测和限制性酶解分析,发现Ser357磷酸化诱导PDI分子呈现开放的构象。有意思的是,该位点的磷酸化使得PDI从一个帮助蛋白质氧化折叠的氧化还原酶转变为一个抑制错误折叠蛋白聚集的分子伴侣,即从“Foldase”转变为“Holdase”。这一功能转换使PDI在ER 应激条件下得以发挥维持蛋白质稳态和细胞存活的作用。IRE1介导的UPR通路对于细胞命运的‘生死抉择’十分重要,其适度活化能促进细胞存活而过度活化则会引起细胞凋亡。磷酸化的PDI还能直接结合在ER 应激 “传感器” IRE1的腔侧结构域,抑制其过度活化。研究者进一步在小鼠模型中证实,ER应激时PDI S359A Knock-in小鼠的肝脏表现出更强的IRE1活化水平、更高的促炎和促凋亡信号以及更明显的肝损伤,说明磷酸化的PDI可抑制IRE1过度活化引起的肝细胞凋亡。
这一研究不仅揭示了细胞通过Fam20C磷酸化PDI来快速灵敏地应对ER应激的新机制,而且发现了PDI是一种新的应激激活的分子伴侣,完美诠释并丰富了王志珍院士和邹承鲁院士在上世纪90年代提出的“PDI既是酶又是分子伴侣”的科学论断。该项研究不仅拓展了我们对于ER应激领域的认识,也有望为ER应激相关疾病的研究提供新的生物标志物和干预手段。
该项工作在线发表于2020年3月9日的《The EMBO Journal》杂志(DOI:10.15252/embj.2019103841)。中科院生物物理所王志珍课题组王磊研究员为该论文的通讯作者,博士研究生于娇娇和李涛为该论文的共同第一作者。生物物理所王立堃研究员、娄继忠研究员以及大连化物所刘宇研究员参与了研究工作。该研究也得到北京大学肖俊宇研究员以及生物物理所徐平勇研究员的帮助。生物物理所科学研究平台为该研究提供了重要的技术支持。该研究受到国家重点研发计划、国家自然科学基金和中科院青年创新促进会的资助。
1965年,中国科学家完成了牛结晶胰岛素的合成,这一成果深深地震撼了刚从大学毕业的王志珍。1970年前后,探索胰岛素的分子结构、功能以及合成机理的研究逊色展开,她抓住这辆疾驰而来的火车,从此与蛋白质研......
二硫键的形成对于真核生物的分泌蛋白和质膜蛋白在内质网中的折叠十分重要。在动物和酵母中,内质网氧化还原蛋白oxidoreductin-1(Ero1)是二硫键的主要供体,将二硫键通过蛋白质二硫键异构酶(P......
尽管首个磷酸化蛋白酪蛋白(casein)在1883年就被报道,直到2012年第一个分泌途径蛋白激酶Fam20C才被鉴定,它催化包括酪蛋白在内绝大多数分泌蛋白的磷酸化。近年来的研究表明,Fam20C参与......
3月20日,国际期刊《美国国家科学院院刊》(PNAS)在线发表了中国科学院生物物理研究所柯莎(SarahPerrett)研究组题为KineticsoftheconformationalcycleofH......
内质网(endoplasmicreticulum,ER)是真核细胞分泌蛋白和膜蛋白的折叠工厂。细胞内外环境的变化会引起ER稳态(包括蛋白质稳态、氧化还原稳态和钙稳态等)失衡。当ER的蛋白质折叠负担超过......
内质网(endoplasmicreticulum,ER)是真核细胞分泌蛋白和膜蛋白的折叠工厂。细胞内外环境的变化会引起ER稳态(包括蛋白质稳态、氧化还原稳态和钙稳态等)失衡。当ER的蛋白质折叠负担超过......
内质网(endoplasmicreticulum,ER)是真核细胞分泌蛋白和膜蛋白的折叠工厂。细胞内外环境的变化会引起ER稳态(包括蛋白质稳态、氧化还原稳态和钙稳态等)失衡。当ER的蛋白质折叠负担超过......
内质网(endoplasmicreticulum,ER)是真核细胞分泌蛋白和膜蛋白的折叠工厂。细胞内外环境的变化会引起ER稳态(包括蛋白质稳态、氧化还原稳态和钙稳态等)失衡。当ER的蛋白质折叠负担超过......
帕金森病是一类常见的神经退行性疾病。在这些患者的神经细胞里,往往能看到一类叫做路易小体(Lewybodies)的结构,里头是α突触核蛋白的积聚。如何针对这类蛋白,避免路易小体的产生,也是帕金森病治疗领......
细胞蛋白质量关系着生物的生存。在衰老过程中生物维持蛋白质量的能力会逐渐下降,受损蛋白和错误折叠蛋白的累积起来会造成细胞死亡和细胞功能故障。阿尔茨海默症、帕金森症、亨廷顿舞蹈病等神经退行性疾病就与蛋白质......