质量标准的制订
杂质和辅料的定位
对于已知降解 杂质A和B,通常采用对照品法或相对保留时间法,前者需制备对照品并供日常检测用,后者简便易行,故推荐后者。检测制剂时有时会出现辅料峰,保留时间通常 较短,可采用“扣除主成分峰相对保留时间多少倍前的辅料峰”的办法;如辅料峰位于中间位置,则只能在质量标准中规定:取某辅料、配制成某浓度进样测定,该 辅料峰不计入的办法。
杂质定量法
由于杂质与主成分结构式不同、紫外吸收不同,故在同一波 长下采用峰面积代表含量时需引入校正因子。针对杂质A和B的校正因子,如文献报道值已翔实确凿,则可直接采用;如怀疑或不存在报道值,则采用液质联用仪或 其他检测手段,甄别出该两杂质结构式,随后从国外药典会或某实验室购买来测得该杂质校正因子;或通过自我合成制备 → 结构式确认→ 获得纯度值 → 测得校正因子。这里需提醒的是:无论何种途径获得的杂质对照品,纯度值无需很高,只要该值准确、误差范围以内即可。针对特有杂质E和F,也是遵循以上方法 获得校正因子后计算含量。通常,校正因子在0.9~1.1时可忽略,超出0.5~5.0时应考虑改变检测波长,如无法调节,应考虑采用杂质对照品法。
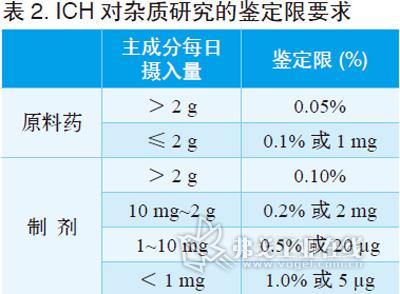
杂质限度的规定
由于杂质A和B是主成分降解杂质,故其限度值在既有标准应有规定,参照即可其他杂质无需再参照既有质量标准,可自行拟定为:其他最大单个未知杂质不得过 0.5%,其次单个未知杂质不得过0.2%,所有杂质不得过1.5%。针对五类改剂型的研发,当用药途径一致时,仍可参照该限度制订;若用药途径发生改 变,则应具体分析。
系统适用性试验
系统适用性试验除在方法开发时用到,在日常检测中也应被使用,从而保证即时的色谱条件可满足测定需要。英国药典在所有液相法检测有关物质时均有此项规定。通常可采用如下方法。
使用与主成分最难分离的杂质;
如知晓原料药合成中间体G是最紧邻主成分峰前的杂质,可将其拟定入系统适用性试验中,只要保证该杂质与主成分峰的分离,便可确保其他杂质的分离;
使用已知杂质对照品;
如采用对照品法测定杂质A,则可规定该杂质峰与主成分峰具有适当的分离度,以保证位于中间的杂质B与G能与主成分峰分开,而不能仅规定1.5的分离度。
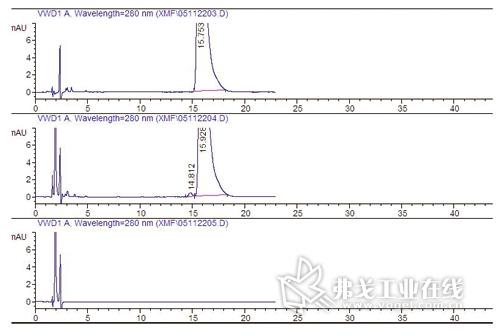
图3. 系统适用性强破坏试验图谱(下/空白溶剂;上/未破坏的供试品溶液;中/氧化破坏试验:规定产生一主成分峰前的杂质峰,且分离度应符合规定)。
采用破坏试验
如主成分在某强破坏试验下较易产生杂质,且该杂质又在质量标准中有所规定限制,则可采用,如图3所示。不建议仅规定主成分峰柱效、拖尾因子等作法,这些参数无法直接表达出主成分与杂质的分离效果。
复方制剂的研究
研究思路同前,仍是主要关注降解新增杂质,来源可能为:各原料间相互作用、原料与辅料间相互作用、原辅料与包材间相互作用等。不同之处如下。
色谱系统
研究阶段,通过确定色谱柱型号加以区域性分离、明确各杂质归属后进行检测的方法最为常用,且当一套色谱系统难以将各主成分与杂质均分离时,可建立两套/多套 色谱系统进行测定。如色谱系统一测定主成分A及其杂质,色谱系统二测定主成分B与其杂质,并验证在该各自系统条件下彼此互不干扰。
根据研究结果制订质量标准
如经以上研究,所有杂质均未增加/变化,则可在质量标准中不予制订有关物质检查项,该思路对于氨基酸等大复方制剂更为适用。如仅主成分A的一个已知杂质不断增加,则质量标准中仅制订该杂质测定法与限度。
很多研究者由于未充分理解制剂质量标准仅关注降解杂质的理念,将所有杂质均订入了质量标准。不变化的杂质由于已在原料药/辅料中加以了制御,故制剂质量标准中便无需再控制。
经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第九十三批)。特此通告。附件:化学仿制药参比制剂目录(第九十三批)国家药监局2025年7月7日......
2025年02月27日,河北药监局发布了关于印发《2025年全省药品监督管理工作要点》的通知,通知中对专业化监管队伍、促进京津冀协同发展、深化药品监管改革、建立约谈管理办法、推进仿制药一致性评价、优化......
国家药监局关于发布仿制药参比制剂目录(第九十批)的通告(2025年第9号)经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第九十批)。特此通告。国家药监局2......
2025年2月9日,国家医保局联合药监部门针对集采药品质量问题的争议给出明确回应,并提出一系列优化监管措施,希望消除公众疑虑,确保药品集中带量采购政策(简称“集采”)的平稳推进,让患者用上“低价优质药......
近日,第十批国家组织药品集中带量采购的拟中选结果公布,部分国产仿制药以极低价格中选,引发了广泛关注。其中,阿司匹林肠溶片的最低中标价仅为3分钱一片。与此同时,流感高发期的到来使得抗流感药物需求激增。尽......
国家药监局关于发布仿制药参比制剂目录(第八十四批)及调出参比制剂目录品种清单(第一批)的通告(2024年第46号)经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂......
药品包装上的通用名常显著标示,单字面积大于商品名的2倍;在横版标签上,通用名在上1/3范围内显著位置标出(竖版为右1/3范围内);字体颜色使用黑色或者白色。药品包装上的商品名一般与通用名分行书写,其单......
国家药监局关于发布仿制药参比制剂目录(第八十四批)及调出参比制剂目录品种清单(第一批)的通告(2024年第46号)经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂......
国家药监局关于发布仿制药参比制剂目录(第八十三批)的通告(2024年第37号)经国家药品监督管理局仿制药质量和疗效一致性评价专家委员会审核确定,现发布仿制药参比制剂目录(第八十三批)。特此通告。国家药......
国药现代(600420)3月7日晚间公告,近日,公司控股子公司国药集团致君(深圳)制药有限公司收到国家药监局核准签发的《药品补充申请批准通知书》,批准注射用头孢哌酮钠舒巴坦钠通过仿制药质量和疗效一致性......