本篇介绍系统适用性试验部分修订内容!

理论塔板数、分离度
现行版通则:当对测定结果有异议时,色谱柱的理论板数(n)和分离度(Rs)均以峰宽(W)的计算结果为准。
修订公示稿提到:当对测定结果有异议时,色谱柱的理论板数(n)和分离度(Rs)应以半高峰宽(Wh/2)的计算结果为准。
变化:当存在测定结果异议时,原计算结果判定计算方式由峰宽改为半高峰宽,同时分离度半高峰宽计算方式涉及的公式系数由2/1.7修订为1.18。

应对方案
1、打开LabSolutions工作站(以LC Ver 5.103及后续版本)再解析-选中数据文件-右下角方法视图-编辑-性能-勾选USP2。

2、在LabSolutions软件中用再解析打开数据-->方法视图-->编辑-->性能-->计算方法-->用户定义-->输入相应的名称和参数。
应用案例
本案例显示半高峰宽计算方式下,理论塔板数、分离度值高于峰宽计算值。
峰谷比
峰谷比项目是本次新增评价参数,公示稿提到若待测物质峰与相邻峰之间未达到基线分离,峰谷比( p / v)可作为系统适用性试验参数。
实现峰谷比计算,需要用垂直积分方式,而不是切向积分方式!如何调出峰谷比计算结果,请参考以下流程图。

灵敏度
公示稿提到信噪比(S/N)用于定义系统的灵敏度,按下式计算:S/N=2 H/h。
在使用规定的参比溶液获得的色谱图中,H为从目标峰最大值到基线信号的峰高,基线外延距离至少为目标峰半高峰宽的5倍;ℎ为使用空白溶液在距离目标峰至少5倍宽范围内观察到的最大和最小噪声的幅度。
目前在计算信噪比时,信号和噪音以当前数据为准,公示稿要求在计算中选择空白溶液数据计算噪音幅度,并且基线外延距离要求至少是5倍半高峰宽距离。
应对方案
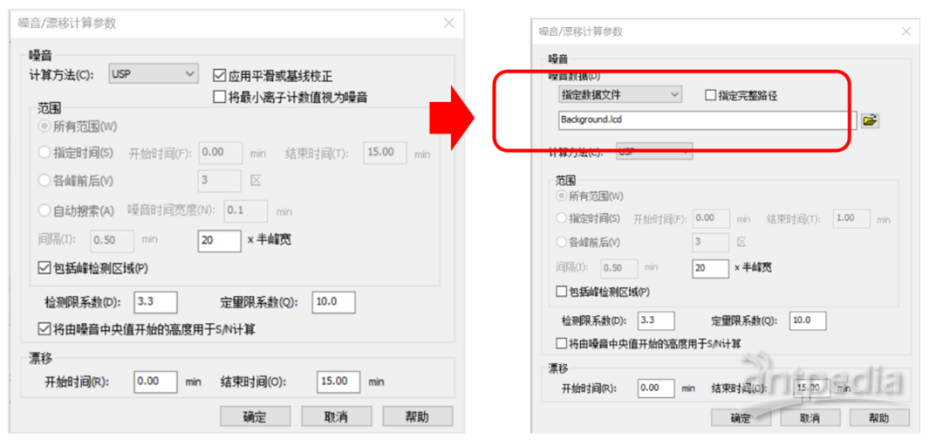
使用LabSolutions控制LC、GC、GCMS、LCMS(包括DB版)时操作方法都需要添加空白数据,目前岛津工作站已全面支持公示稿要求计算方式。较早版本软件在处理LCMS数据时没有选择空白溶液数据选项,在2023年1月后的软件版本:LCMS Ver.5.120对此做了增补,如下图:
拖尾因子
公示稿新增内容:除另有规定外,在检查和含量测定项下,以峰面积作定量参数时,T值应在0.8~1.8 之间。
重复性
公示稿新增内容:如品种项下规定相对标准偏差大于2.0% ,则以重复进样6次的数据计算。
其他参数
增加保留时间和相对保留时间作为评价系统适用性参数的描述,岛津技术团队查阅了以下相关标准及发布文件中涉及相对保留时间方法应用。
1、《中国药典》2020年版二部化学药品及第一增补本有大量品种在“系统适用性要求”或“限度”行下有相对保留时间说明。
2、《中国药典》2020年版一部中药及第一增补本约有20个品种使用一标多测法(也称一测多评法)作为多成分含量测定方法,其中色谱峰定位应用了相对保留时间方法。
3、《中药配方颗粒国家标准申报资料目录及要求》中明确特征峰相对保留时间规定值范围:一般应不超过±10%范围。若超过±10%范围,可考虑增加参照物,即特征图谱测定中采用1个或多个参照物分别对不同特征峰的相对保留时间做出规定。
4、《中药配方颗粒质量控制与标准制定技术要求》中明确特征图谱:建议采用液相或气相色谱法,比较主要成份色谱峰的个数,规定其相对保留时间等。
5、《中药特征图谱研究技术指导原则(征求意见稿)》明确中药特征图谱一般可对峰的保留时间、相对峰面积等进行评价,应根据品种自身特点选择评价方法,特征峰相对保留时间规定值范围一般应不超过±10%。
应对方案
结果判定智能评价报告工具 MDR(多数据报告)
什么是MDR:Multi-Data Report(MDR),中文名称:多数据报告,是LabSolutions DB/CS的内置小软件,作用是通过调用其他分析设备的数据制作综合报告。
多数据报告(MDR)功能
● 可自动提取各特征峰的保留时间、峰面积以及自动计算相对保留时间和相对峰面积。
● 根据法规和分析要求进行结果的自动判断(如符合/不符合规定),失败结果自动标识。支持多个参考峰。
● 支持权限管理和审计追踪,数据安全和完整性有保障。

应用案例

注:本文中所用数据均为岛津实验室特定条件下的测试数据,结果可能随实际情况变动。
导读2023年10月12日,国家药监局发布公告,《中国药典》2020年版第一增补本将于2024年3月12日正式实施。岛津技术团队对药典一部中药增修订项目变化进行了汇总,并开发了解决方案,助您从容应对!......
离子色谱在医药中应用广泛,主要用于药物成分分析、药品质量控制、药物稳定性研究、药用辅料分析以及临床检验与诊断等。例如,在检测药物制剂中的无机离子、有机酸等杂质,监控原料药及制剂的离子污染物,评估药物稳......
本篇介绍系统适用性试验部分修订内容!理论塔板数、分离度现行版通则:当对测定结果有异议时,色谱柱的理论板数(n)和分离度(Rs)均以峰宽(W)的计算结果为准。修订公示稿提到:当对测定结果有异议时,色谱柱......
本篇介绍系统适用性试验部分修订内容!理论塔板数、分离度现行版通则:当对测定结果有异议时,色谱柱的理论板数(n)和分离度(Rs)均以峰宽(W)的计算结果为准。修订公示稿提到:当对测定结果有异议时,色谱柱......
本篇介绍系统适用性试验部分修订内容!理论塔板数、分离度现行版通则:当对测定结果有异议时,色谱柱的理论板数(n)和分离度(Rs)均以峰宽(W)的计算结果为准。修订公示稿提到:当对测定结果有异议时,色谱柱......
本篇介绍系统适用性试验部分修订内容!理论塔板数、分离度现行版通则:当对测定结果有异议时,色谱柱的理论板数(n)和分离度(Rs)均以峰宽(W)的计算结果为准。修订公示稿提到:当对测定结果有异议时,色谱柱......
国家药品监督管理局于2023年11月9日发布通告,指出神威药业集团有限公司(以下简称“神威药业”)生产的1批次炒酸枣仁配方颗粒不符合规定。据浙江省食品药品检验研究院的检验报告,该批次药品存在微生物限度......
细菌内毒素检查法在药品生产和检测过程中具有重要意义。根据《美国药典》规定,应使用国家参考标准内毒素(RSE),复溶后应旋涡振荡不少于20分钟,并在冰箱中保存不超过14天。再次使用前需要强烈旋涡振荡不少......
2022年底,国家药典委员会发布《中国药典》(2025年版)编制大纲的通知。《通知》显示,到2025年,全面完成新版《中国药典》编制工作。符合中医药特点的中药标准进一步完善,化学药品、生物制品、药用辅......
《中国药典》是一个国家记载药品标准和相关技术规定的法典。由国家药品监督管理部门或法律授权部门主持编纂、颁布实施。作为我国保证药品质量的法典,中国药典在保持科学性、先进性、规范性和权威性的基础上,着力解......